- Alkane
- Homologe Reihe der Alkane
- Benennung der Alkane
- Regeln zur Ermittlung des Namens
- Beispiel
- Alkene
- Einführung
- Primäre, sekundäre, tertiäre und quartäre Kohlenstoffatome
- Alkine
- Isomere Verbindungen
- E/Z-Isomerie
- Physikalische Eigenschaften der Alkane
- Siede- und Schmelztemperaturen von unverzweigten Alkanen
- Siedetemperaturen von isomeren Molekülen
- Löslichkeit
- Brennbarkeit der Kohlenwasserstoffe
- Halogenierung von Alkanen
- Wiederholung
- Radikalische Substitution
- Beispiel: Bromierung von Heptan
- Vorgang der Radikalischen Substitution
- Die elektrophile Addition
- Einführung
- Reaktionsmechanismus
- 1. Schritt: Polarisierung des Halogenmoleküls
- 2. Schritt: Anlagerung des ersten Bromatoms
- 3. Schritt: Anlagerung des zweiten Bromatoms
Alkane
Alkane sind Kohlenwasserstoffe, deren einzige Bestandteile Kohlenstoff und Wasserstoff sind. Jedes Kohlenstoffatom geht dabei genau vier Einfachbindungen ein. Es kann daher mit keinen weiteren Atomen verknüpft werden. Deshalb sind Alkane gesättigte Kohlenwasserstoffe.
Homologe Reihe der Alkane
Durch diesen grundlegenden Aufbau ergibt sich eine homologe Reihe, die sich an der Anzahl der Kohlenstoffatome orientiert. Die ersten Moleküle dieser Reihe sind folgende:
| Methan | Ethan | Propan | Butan | Pentan |
| Hexan (C6H14) | Heptan (C7H16) | Octan (C8H18) | Nonan (C9H20) | Decan (C10H22) |
Man erkennt leicht, dass man die Kette durch den Einschub einer CH2-Gruppe (Methylengruppe) verlängern kann. Die allgemeine Strukturformel für ein kettenförmiges Alkan lautet daher:
Ermittelt man die Summenformeln der Alkane, also die Zusammenfassung auf die bloße Anzahl der einzelnen Atome, erhält man (für Methan bis Hexan) die Ergebnisse CH4, C2H6, C3H8, C4H10, C5H12, C6H14. Allgemein lässt sich sagen, dass eine n-lange Kette die Formel CnH2n+2 besitzt.
Benennung der Alkane
Das zentrale Gremium für die Benennung von chemischen Verbindungen ist die IUPAC („International Union of Pure and Applied Chemistry“). Ihre Vorgaben für die Nomenklatur von chemischen Verbindungen sind einzuhalten.
Regeln zur Ermittlung des Namens
- Zuerst wird die längste durchgehende Kette aus Kohlenstoffatomen ermittelt. Diese Kette kann auch „Knicke“ enthalten. Aus der Anzahl der Kohlenstoffatome ergibt sich die Endung des Namens (z.B. „-butan“).
- Als nächstes werden die Seitenketten nach der Anzahl der Kohlenstoffatome benannt; sie bekommen die Endung „-yl“ (z.B. -CH3: Methylgruppe, C2H5, Ethylgruppe).
- Die Namen der Seitenkette werden dem Namen der Hauptgruppe alphabetisch vorangestellt; eine Ethylgruppe kommt also vor eine Methylgruppe.
- Man ermittelt die Anzahl der gleichen Seitenketten und kennzeichnet sie bei wiederholtem Vorkommen durch das entsprechende griechische Zahlwort (also 2 = di, 3 = tri, etc.).
- Abschließend werden die Verknüpfungsstellen zwischen Haupt- und Seitenketten ermittelt; dabei wird die Hauptkette so durchnummeriert, dass die Verknüpfungsstellen kleinstmögliche Zahlen erhalten. Kommt eine Seitenkette häufiger vor, schreibt man die Verknüpfungsstelle durch ein Komma getrennt direkt hintereinander.
Beispiel
Zur Verdeutlichung soll das Molekül rechts benannt werden. Dafür werden die oben beschriebenen Schritte nochmals einzeln durchgegangen.
- Die längste Kette sind die horizontal dargestellten Kohlenstoffatome. Sie ist sieben Atome lang. Das Molekül erhält daher die Endung „-heptan“.
- Wir haben insgesamt drei Seitenketten. Zwei sind Methylgruppen (-CH3); die dritte ist eine Ethylgruppe(-C2H5).
- Sie werden alphabetisch vorangestellt. Man erhält damit „Ethyl-methylheptan“.
- Nun wird bei der Methylgruppe ein „di“ vorangestellt, da zwei solcher Seitenketten vorliegen. Die Ethylgruppe benötigt kein Präfix. Dadurch hat man bis jetzt „Ethyl-dimethylheptan“.
- Zum Schluss werden die Nummern der Verknüpfungsstellen ermittelt. Hier bekommt das Kohlenstoffatom, an dem die beiden Methylgruppen hängen, die drei. Damit erhält man als abschließenden Namen „4-Ethyl-3,3-dimethylheptan“.
Alkene
Einführung
von Ethen
Befindet sich in einem Kohlenwasserstoffmolekül auch eine oder mehrere Doppelbindungen, so spricht man von Alkenen. Bei der Namensgebung sind die Regeln der Alkane zu beachten, wobei anstelle der Endung -an die Endung -en verwendet wird, z.B. Ethen, Propen.
Außerdem hat die Mehrfachbindung die höhere Priorität, das heißt, dass die Nummerierung der Kohlenstoffkette so zu wählen ist, dass das Kohlenstoffatom, von dem die Mehrfachbindung ausgeht, die kleinstmögliche Zahl erhält. Vor die Endung „-en“ wird dabei die Stelle der Doppelbindung angegeben.
Primäre, sekundäre, tertiäre und quartäre Kohlenstoffatome
Die Kohlenstoffatome können in primäre, sekundäre, tertiäre und quartäre unterteilt werden. Als Beispiel dient das rechts stehende Molekül 2,4,4,5-Tetramethylhept-2-en.
Das erste Kohlenstoffatom (C1) ist ein sogenanntes primäres Kohlenstoffatom, weil es mit einem weiteren Kohlenstoffatom verbunden ist. Dementsprechend ist das C6 ein sekundäres Kohlenstoffatom (verbunden mit zwei Kohlenstoffatomen), C5 ein tertiäres Kohlenstoffatom (drei Kohlenstoffatome) und C4 ein quartäres Kohlenstoffatom (vier Kohlenstoffatome).
Alkine
Des Weiteren gibt es Alkine. Sie sind Kohlenwasserstoffe, die mindestens eine Dreifachbindung haben. Ebenso wie bei den Alkenen sind bei der Benennung die oben genannten Regeln zu beachten. Die Moleküle erhalten als Endung ein „-in“. So hat das Molekül mit der Summenformel C2H2 den Namen Ethin (rechts dargestellt).
Isomere Verbindungen
Besitzen Alkane mehr als drei Kohlenstoffatome, so können sie nicht nur unverzweigte, sondern auch verzweigte Ketten bilden.
Als Beispiel dienen hier die zwei möglichen Formen, in denen Butan, also ein Molekül mit vier Kohlenstoffatomen und 10 Wasserstoffatomen, vorkommen kann: n-Butan (die unverzweigte Verbindung) und 2-Methylpropan.
| Strukturformel von n-Butan | Strukturformel von 2-Methylpropan |
n-Butan und 2-Methylpropan (=Isobutan) sind Isomere, da sie bei gleicher Anzahl von Atomen unterschiedlich miteinander verknüpft sind. Die beiden Moleküle haben voneinander verschiedene Konstitutionen und unterschiedliche Eigenschaften.
Man spricht bei unterschiedlicher Reihenfolge der Atome von Konstitutionsisomerie (Strukturisomerie).
E/Z-Isomerie
Bei But-2-en tritt eine weitere Art von Isomerie auf. Dazu muss man den Molekülbau genauer betrachten. Vergleicht man Butan mit But-2-en, so erkennt man, dass bei ersterem an allen Einfachbindungen eine freie Drehbarkeit um die C-C-Bindungsachse möglich ist.
Bei But-2-en ist an der Doppelbindung zwischen dem zweiten und dritten Kohlenstoffatom keine Drehbarkeit mehr vorhanden:
| Z-But-2-en | E-But-2-en |
Wie man erkennt, stehen beim Z-Isomer beide Methylgruppen auf der gleichen Seite der Doppelbindung (Z = zusammen). Beim E-Isomer befinden sich die Methylgruppen auf gegenüberliegenden Seiten (E = entgegen). Man kann diese E/Z-Isomerie auch als cis/trans-Isomerie bezeichnen.
Diese Art der Isomerie kann nur auftreten, wenn
- eine Doppelbindung vorliegt und
- sich an jedem der beiden Kohlenstoffatome der Doppelbindung je zwei verschiedene Atome oder Atomgruppen befinden.
Physikalische Eigenschaften der Alkane
Siede- und Schmelztemperaturen von unverzweigten Alkanen
Die homologe Reihe der Alkane weist steigende Schmelz- und Siedetemperatur auf. Diese Temperaturen hängen von der Art und der Anzahl der zwischenmolekularen Kräfter ab.
Durch die nur vorhandenen Kohlenstoff-Wasserstoff-Bindungen, sind nur geringe Polaritäten wegen der geringen Unterschiede in der Elektronegativität vorhanden. Durch die tetraedrische Anordnung der Bindungspartner um das Kohlenstoffatom sind Alkane auch keine Dipole. Es treten daher nur Van-der-Waals-Kräfte und induzierte Dipole zwischen Alkanen auf.
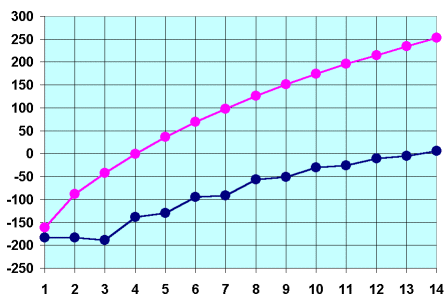
Das nebenstehende Diagramm zeigt, dass mit wachsender Kettenlänge (und damit wachsender Oberfläche), die Schmelz- und Siedetemperaturen steigen, da hierbei die Entstehung von Polarisierungsmöglichkeiten zunimmt. Dadurch nehmen auch die zwischenmolekularen Kräfte zu.
Bei höheren Alkanen (ab etwa 20 Kohlenstoffatomen), sind die Anziehungskräfte zwischen den Molekülen so groß, dass bei entsprechender Energiezufuhr die Bindungen im Alkanmolekül gespalten werden, bevor die Van-der-Waals-Kräfte aufgehoben werden, was zur Folge hat, dass eine Zersetzung unterhalb der Siedetemperatur stattfindet.
Siedetemperaturen von isomeren Molekülen
Nimmt man die isomeren Pentanmoleküle und betrachtet ihre Siedetemperaturen, so erhält man folgende Werte: n-Pentan: 36°C, 2-Methylbutan: 28°C, 2,2-Dimethylpropan: 10°C.
Die Ursache in den unterschiedlichen Siedetemperaturen liegt darin, dass das unverzweigte n-Pentan eine große Oberfläche besitzt (stärkere Van-der-Waals-Kräfte) und 2,2-Dimethylpropan einen fast kugelförmigen Bau hat (und damit eine kleine Oberfläche). Die intermolekularen Kräfte (und damit die Siedetemperaturen) nehmen also von n-Pentan zu 2,2-Dimethylpropan ab.
Löslichkeit
Alle Alkane sind ineinander löslich. Sie gehen jedoch keine Lösung mit Wasser ein und sind damit hydrophob, da zwischen polaren Wassermolekülen Wasserstoffbrückenbindungen bestehen und zwischen den unpolaren Alkanmolekülen Van-der-Waals-Kräfte. Dadurch sind sie jedoch in Fett löslich, also lipophil.
Brennbarkeit der Kohlenwasserstoffe
Alkane, Alkene und Alkine reagieren mit Sauerstoff und verbrennen zu Wasser und Kohlenstoffdioxid:
- Verbrennung von Alkanen:
$ \mathrm{2\,C_2H_6 + 7\,O_2 \;\longrightarrow\; 4\,CO_2 + 6\,H_2O} $
- Verbrennung von Alkenen:
$ \mathrm{C_2H_4 + 3\,O_2 \;\longrightarrow\; 2\,CO_2 + 2\,H_2O} $
- Verbrennung von Alkinen:
$$ \mathrm{2\,C_2H_2 + 5\,O_2 \;\longrightarrow\; 4\,CO_2 + 2\,H_2O} $$
In der homologen Reihe der Alkane nimmt das Leuchten der Flamme mit Steigern der Anzahl an Kohlenstoffatomen zu. Bei gleicher Luftzufuhr findet zunehmend eine unvollständige Verbrennung statt. Dies liegt daran, dass durch die erhöhte Anzahl nicht jeder Kohlenstoff einen Reaktionspartner „findet“.
Verbrennt man Ethin (auch Acetylen genannt), entsteht eine stark leuchtende Flamme; bei der Verbrennung mit reinem Sauerstoff erhält man eine helle, heiße Flamme von bis zu 3000°C, mit der man sogar Stahl schmelzen kann.
Halogenierung von Alkanen
Wiederholung
Spaltet man ein Chlormolekül, so vollzieht man eine homolytische Spaltung. Man erhält zwei Chloratome mit einem freien Elektron. Sie sind daher sehr reaktionsfreudig und werden als Radikale bezeichnet. Die Spaltung von Wasserstoffchlorid vollzieht sich heterolytisch.
Radikalische Substitution
Ersetzt man ein Wasserstoffatom in einem Kohlenwasserstoffmolekül durch einen anderen Bindungspartner (einem Atom oder einer Atomgruppe),spricht man von einer Substitution. Eine typische Reaktion der Alkane ist die radikalische Substitution.
Beispiel: Bromierung von Heptan
Man möchte Heptan bromieren, also ein Wasserstoffatom durch ein Bromaton ersetzen. Gibt man hierzu einige Tropfen Brom zu Heptan, so entfärbt sich die Lösung, das heißt, das Brom hat mit dem Alkan reagiert. Über der Flüssigkeit erfolgt in feuchter Luft eine Nebelbildung: Es hat sich Bromwasserstoff gebildet.
Es entsteht allgemein bei jeder Substitution neben dem halogenierten Produkt immer das entsprechende Wasserstoffhalogenid. Lässt man zum Beispiel Methan mit Chlor reagieren, entsteht Tetrachlorkohlenstoff und Chlorwasserstoff.
Vorgang der Radikalischen Substitution
Bei der radikalischen Substitution wird ein Halogenmolekül gespalten; dadurch entsteht ein Halogenradikal. Dies ist die Startreaktion. Ein Alkan reagiert mit einem Halogenmolekül zu einem Alkylradikal (ein Wasserstoffatom wurde entfernt) und einem Wasserstoffhalogenid (z.B. HBr). Das Alkylradikal und ein weiteres Halogenmolekül reagieren dann zu Halogenalkanen und Halogenradikalen.
Abbruchreaktionen, also Reaktionen, die dazu führen, dass die Substitution nicht mehr erfolgt, können folgende sein:
- Halogenradikale reagieren zu Halogenmolekülen
- zwei Alkylradikale reagieren zu einem Alkan
- ein Alkylradikal und ein Halogenradikal reagieren zu Halogenalkan
Die elektrophile Addition
Einführung
Alkene und Alkine können – im Gegensatz zu Alkanen – die so genannte elektrophile Addition mit Halogenmolekülen eingehen. Wie bereits der Name sagt, wird hier nichts ersetzt, sondern ergänzt. Dabei lagert sich das Halogen an die Stelle an, an der die Doppelbindung war, indem es diese aufbricht:
Hier wurde Ethen bromiert. Es entsteht dabei 1,2-Dibromethan. Dies ist auch eine Nachweisreaktion für ungesättigte Kohlenwasserstoffe: Das braune Bromwasser entfärbt sich bei Anwesenheit dieser.
Reaktionsmechanismus
Im Folgenden wird der Reaktionsmechanismus im Einzelnen dargestellt. Rechts wird er auch Schritt für Schritt erläutert.
1. Schritt: Polarisierung des Halogenmoleküls
Nähert sich das Halogenmolekül (hier: Brom) dem Alken (hier: Ethen) oder Alkin, wird es aufgrund der erhöhten negativen Ladungsdichte der Mehrfachbindung polarisiert.
2. Schritt: Anlagerung des ersten Bromatoms
Als nächstes kann das Bromatom, das dem Ethen zugewandt ist, die Doppelbindung des Ethens wegen seiner positiven Ladung aufbrechen. Dabei wird das Brommolekül heterolytisch aufgespalten, es entsteht ein Bromid-Ion. Das Molekül ist nun positiv geladen.
3. Schritt: Anlagerung des zweiten Bromatoms
Als letztes lagert sich das Bromid-Ion an das andere Kohlenstoffatom, das positiv geladen ist. Dadurch werden beide elektrisch neutral.