Reaktionsgeschwindigkeit und Enzymkatalyse
Reaktionsgeschwindigkeit
Definition
Reaktionen verlaufen in unterschiedlichen Geschwindigkeiten. Während etwa der Rostvorgang eine sehr langsam verlaufende Reaktion ist, ist die Reaktion zwischen Wasserstoff und Sauerstoff bei der Knallgasprobe sehr schnell.
Diese Unterschiede lassen sich mit der Reaktionsgeschwindigkeit $v_R$ ausdrücken. Sie ist definiert als die Änderung der Stoffmenge $n$ in einer bestimmten Zeit $t$:
Versuch zur Ermittlung der Reaktionsgeschwindigkeit
Dies lässt sich etwa an folgendem Versuch darstellen:
Lässt man 8 ml Salzsäure (1 mol · l-1) circa 15 Minuten auf eine Spatelspitze Zink einwirken und fängt man den entstehenden Wasserstoff in einem Kolbenprober auf, kann man das Wasserstoffvolumen ablesen. Diese Werte ergeben folgendes Diagramm:
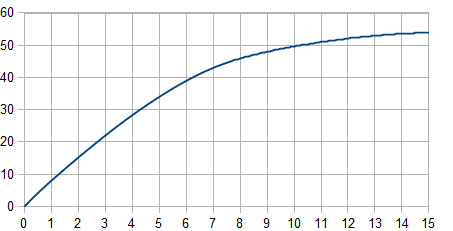
Durchschnittsgeschwindigkeit
Die Durchschnittsgeschwindigkeit $\overline{v_R}$ ist der Quotient aus der Volumenänderung und den zwei Zeitpunkten $t_1$ und $t_2$. Werden die Bedingungen nicht geändert, d.h. der Druck und die Temperatur bleiben konstant, verhält es sich bei den Stoffmengen proportional:
Momentangeschwindigkeit
Möchte man die Geschwindigkeit zu einem bestimmten Zeitpunkt, also die sogenannte Momentangeschwindigkeit ermitteln, nähert man die zwei Zeitpunkte immer weiter an. Die mittlere Geschwindigkeit des kleinstmöglichen Zeitabschnitts $\Delta t$ ist dann die Momentangeschwindigkeit.
Beschreibung der Reaktionsgeschwindigkeit
Um die Reaktionsgeschwindigkeit zu ermitteln, verwendet man entweder das Edukt oder das Produkt. Gewählt wird, was leichter zu messen ist. Da Masse und Volumen direkt proportional zur Stoffmenge sind, können die Zunahme der Produkte oder die Abnahme der Edukte herangezogen werden:
Stoßmodell
Beispiel: Bildung von Wasserstoffiodid
Die Teilchen bewegen sich mit einer bestimmten Energie frei im Raum; zu einer Reaktion kann es kommen, wenn zwei Teilchen zusammenstoßen. Allerdings führt nicht jeder Zusammenstoß zu einer Reaktion. Dies kann zwei Gründe haben:
- Die Teilchen stoßen ohne die richtige gegenseitige Orientierung zusammen oder
- Sie besitzen nicht die notwendige Aktivierungsenergie