- Der räumliche Bau von Molekülen
- Das Orbitalmodell
- Beispiel: Wasserstoff und Helium
- Benennung der Orbitale:
- Pauling-Schreibweise
- Einführung
- Beispiele
- Molekülorbital
- Molekülgeometrie
- Warum können Elektronen Paare bilden?
- Abweichungen vom Tetraederwinkel 109,5°
- Mehrfachbindungen
- Zusammenfassung
- Stereochemie
- Überblick Molekülformeln
- Die polare Atombindung
- Beispiel: Wasserstoffchlorid-Molekül
- Ursache der polaren Atombindung
- Dipolmoleküle
- Beispiel: Wasser
- Beispiel: Kohlenstoffdioxid
- Beispiel: Tetrachlorkohlenstoff
- Zwischenmolekulare Kräfte
- Wasserstoffbrückenbindungen
- Van-der-Waals-Kräfte
- Allgemeines
- Vergleich zwischen einem permanenten Dipol und einem spontanen/induzierten Dipol
- Zwischenmolekulare Kräfte und Stoffeigenschaften
- Schmelz- und Siedetemperaturen
- Hydratation
- Lösungsvorgang
- Löslichkeit
Der räumliche Bau von Molekülen
Das Orbitalmodell
Für Elektronen lassen sich mathematisch sogenannte Aufenthaltsräume berechnen. Der Bereich, in dem sich ein Elektron mit hoher Wahrscheinlichkeit befindet, nennt man Orbital. Bei diesen Berechnungen erhält man auch die Orbitalform.
Beispiel: Wasserstoff und Helium
Das Atomorbital eines Wasserstoffelektrons ist kugelförmig. Nach außen wird die Wahrscheinlichkeit das Elektron anzutreffen immer geringer. Das Orbital ist nach außen hin nicht scharf begrenzt.
Beim Heliumatom sind zwei energetisch gleiche Elektronen vorhanden. Beide Elektronen befinden sich im selben Orbital wie das eine Elektron vom Wasserstoffatom.
Es gibt zahlreiche Orbitalformen, z.B. ein hantelförmiges Orbital, die bei Elementen ab der 2. Periode vorhanden sind. Von diesen hantelförmigen Orbitalen gibt es jeweils drei, die entlang der drei Raumachsen liegen.
Benennung der Orbitale:
Durch Berechnung erhält man unterschiedlich geformte Orbitale. Das kugelförmige Orbital wird s-Orbital, das hantelförmiges Orbital p-Orbital genannt.
S- und p-Orbitale gibt es in jeder Periode; damit man sie unterscheiden kann, setzt man die Nummer der Energiestufe voran. So wird das s-Orbital der 1. Periode als 1s-Orbital genannt und das s- oder p-Orbital der 2. Periode 2s-Orbital bzw. 2p-Orbital.
Pauling-Schreibweise
Einführung
Zur einfachen Übersicht für das „Auffüllen“ der Orbitale kann die Pauling-Schreibweise (auch Kästchenschreibweise genannt), benutzt werden. Dabei stellt ein Kästchen ein Orbital dar. Die Elektronen werden mit einem Pfeil dargestellt; die Richtung gibt dabei den Spin an.
Beim Ausfüllen (allgemein) sind folgende zwei Regeln zu beachten: Zunächst sind energieärmere Orbitale zu besetzen. Energiegleiche Orbitale sind dabei zuerst halb auszufüllen und anschließend doppelt.
Bei der Pauling-Schreibweise werden die energieärmsten Orbitale nach unten geschrieben. In der gleichen „Schale“ ist das s-Orbital dabei energieärmer als das p-Orbital.
Beispiele
An einigen Beispielen soll dies verdeutlicht werden:
Molekülorbital
Die beiden Atome eines Wasserstoffmoleküls werden durch eine Atombindung zusammengehalten; die Bindung über die beiden Elektronen der Wasserstoffatome nennt man Elektronenpaarbindung oder kovalente Bindung. Die Elektronen stammen aus einfach besetzten Atomorbitalen.
Ein Molekülorbital kann zwischen Wasserstoffatomen nur entstehen, wenn sich die beiden Orbitale gegenseitig durchdringen (sogenannte Überlappung). Es kommt zur Ausbildung eines gemeinsamen Orbitals, das Molekülorbital genannt wird.
Zwischen den Kernen herrschen Abstoßungskräfte; dadurch können sie sich nicht beliebig nähern. Bevorzugter Aufenthaltsbereich der Elektronen ist der Überlappungsbereich, wodurch hier eine erhöhte negative Ladungsdichte herrscht.
Moleküle wie Wasserstoff, Chlor, Hydrogenchlorid (HCl) oder Wasser sind energieärmer als die getrennten Atome, deshalb bilden sie sich aus diesen Atomen. Im Molekül erreichen die gebundenen Atome die Elektronenkonfiguration eines Edelgases (Oktettregel).
Molekülgeometrie
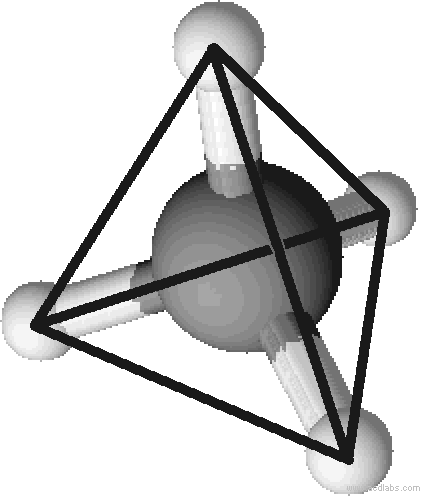
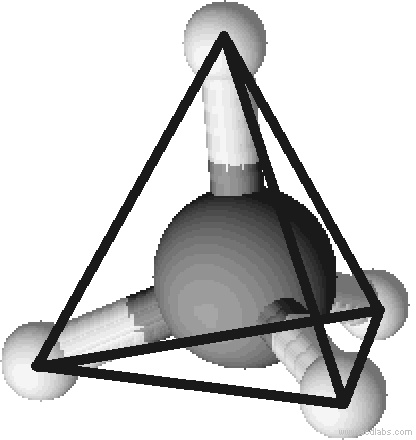
Um die Bindungsverhältnisse zwischen zwei oder mehreren Atomen darzustellen, z.B. für ein Molekül, eignet sich besonders gut die Valenzstrichformel. Mit dieser schaut Methan (CH4) wie auf der rechten Seite aus.
Die Valenzstrichformel sagt aber nichts über die räumliche Gestalt eines Moleküls aus. So könnte man denken, dass alle fünf Atome in einer Ebene liegen, das Molekül also planar gebaut wäre. Messungen ergeben jedoch, dass eine tetraedrische Struktur vorliegt: Die vier Wasserstoffatome befinden sich an den Ecken eines (gedachten) Tetraeders, das Kohlenstoffatom liegt im Zentrum jenes. Der Bindungswinkel zwischen den einzelnen Atomen beträgt dabei 109,5°.
Warum können Elektronen Paare bilden?
Elektronen können in einem Orbital alleine oder mit einem anderen Elektron vorkommen. Sie stoßen sich jedoch aufgrund ihrer gleichartigen elektrischen Ladung ab. Trotz dieses „Abstoßungseffekts“ ist dies möglich. Er wird nämlich durch den so genannten Spin (oder Eigendrehimpuls) des Elektrons überlagert.
Elektronen können in dieser Eigenrotation gleich oder verschieden sein. Ein entgegengesetzter Spin mindert die Abstoßung. So können sich spinverschiedene Elektronen nähern und Elektronenpaare in einem Orbital bilden.
Die Elektronen in einem Orbital sind trotz ihres verschiedenen Spins dennoch energetisch gleich. Damit treten die acht Elektronen der Elektronenkonfiguration als vier Elektronenpaare in vier Orbitalen auf.
Nach dem Elektronenabstoßungsmodell (EPA-Modell) kann folgende Aussage gemacht werden: Die Elektronen verhalten sich so, als ob sie einander abstoßen würden und ordnen sich daher in möglichst großer Entfernung voneinander an.
Abweichungen vom Tetraederwinkel 109,5°
Vergleicht man ein Methanmolekül mit einem Ammoniakmolekül (NH3), erkennt man folgende Unterschiede:
- Methan: 4 bindende Elektronenpaare, Bindungswinkel 109,5°
- Ammoniak: 3 bindende Elektronenpaare, 1 freies Elektronenpaar, Bindungswinkel 107,3°
Den Unterschied im Bindungswinkel kann damit erklären, dass das Orbital eines nicht bindenden Elektronenpaares einen größeren Raum einnimmt als ein bindendes. Dadurch werden diese aneinander gedrängt und der Bindungswinkel wird kleiner.
Mehrfachbindungen
Mehrfachbindungen kommen dann zwischen zwei Atomen zustande, wenn ein Atom einem anderen nicht nur ein halb besetztes Orbital zur Ausbildung einer Bindung anbieten kann, sondern zwei oder drei solcher Orbitale.
Dies kann man gut an den beiden biatomaren Elementen Sauerstoff und Stickstoff erkennen.
- Sauerstoff: Hier gibt es zwei halb besetzte Orbitale für eine Bindungsbildung, das heißt zwischen zwei Sauerstoffatomen besteht eine Doppelbindung (wodurch beide Atome den Oktettzustand erreichen).
- Stickstoff: Es gibt drei halb besetzte Orbitale und damit eine Dreifachbindung. Auch hier erreichen beide Atome den Edelgaszustand.
Die Molekülorbitale einer Mehrfachbindung brauchen nicht mehr Raum als eine Einfachbindung. Daher werden hier die anderen Orbitale nicht aneinander gedrängt. Betrachtet man zum Beispiel das Kohlenstoffdioxidmolekül, erkennt man, dass ein linearer Bau mit einer Doppelbindung und einem Bindungswinkel von 180° vorliegt.
Zusammenfassung
Um den räumlichen Bau von Molekülen darzustellen, bedient man sich folgender Regeln:
- Elektronenpaare stoßen sich gegenseitig ab und bilden den jeweils größtmöglichen Winkel untereinander.
- Nicht bindende Elektronenpaare benötigen mehr Raum als bindende.
- Mehrfachbindungen werden in ihrer abstoßenden Wirkung wie Einfachbindungen behandelt.
Stereochemie
In der Stereochemie wird die dreidimensionale Struktur der Moleküle untersucht. Die Struktur eines Moleküls hat einen Einfluss auf die Stoffeigenschaften und den Ablauf chemischer Reaktionen.
Nimmt man wieder das Methan, so konnte man nachweisen, dass dieses eine Tetraederstruktur besitzt, da es nur ein Chlormethan-Molekül (CH3Cl) existiert. Von diesem Molekül sind die planare und die tetraedrische Struktur denkbar. Jedoch konnte bewiesen werden, dass es die planare Anordnung nicht gibt (CH2Cl2).
Überblick Molekülformeln
Für eine Übersicht über die verschiedenen Möglichkeiten der Darstellung eines Stoffs soll hier eine Verbindung aus der organischen Chemie dienen: Buttersäure = Butansäure.
| Formelschreibweise | Erklärung/Verwendungszweck | Darstellung der Butansäure |
| Summenformel | bei Molekülen auch Molekülformel genannt; sie zeigt die exakte atomare Zusammensetzung eines Moleküls und wird zum Erstellen einer Reaktionsgleichung genutzt | $ \mathrm{C_4H_8O_2} $ |
| Konstitutionsformel | sie gibt die Verknüpfung der Atome in einer übersichtlichen Schnellschreibweise an | $ \mathrm{C_3H_7COOH} $ |
| Halbstrukturformel | genaue Angabe zur Verknüpfung der Atomgruppen in übersichtlicher Schnellschreibweise | |
| Strukturformel | exakte Darstellung der Verknüpfung der Atome und der nicht bindenden Elektronenpaare; benötigt man zur Darstellung von Reaktionsmechanismen |
Die polare Atombindung
Bisher sind folgende Bindungstypen bekannt: Die Ionenbildung, die bei Salzen vorkommt (z.B. NaCl), und die Elektronenpaarbindung bei Molekülen wie H2 oder Cl2. Bei den meisten Verbindungen liegen die tatsächlichen Bindungsverhältnisse aber zwischen diesen beiden Typen.
Beispiel: Wasserstoffchlorid-Molekül
Beim Wasserstoffchlorid-Molekül (HCl) liegt eine Elektronenpaarbindung vor. Allerdings wird die bindende Elektronenpaarbindung vom Chloratom stärker angezogen als vom Wasserstoffatom. Man sagt, dass das Chloratom elektronegativer ist.
Elektronegativität ist daher die Fähigkeit eines Atoms, die Elektronen innerhalb einer Elektronenpaarbindung an sich zu ziehen.
Aus dem Atomorbital des Wasserstoffatoms und dem des Chloratoms wird ein unsymmetrisches Molekülorbital gebildet. Die negative Ladung ist ungleichmäßig verteilt.
Ursache der polaren Atombindung
Je höher die Kernladungszahl ist und je näher ein Elektron am Kern ist, desto stärker zieht ein Atom die Elektronenpaare an. Um die einzelnen Atome vergleichen zu können, wurde den Elementen von Linus Pauling ein Wert zugeordnet. Dieser Wert ist die Elektronegativität $ EN $.
Fluor wird der höchste Wert von 4,0 zugeordnet ($ EN(\text{F}) = 4,0 $). Den niedrigsten hat Lithium mit 1,0. Weiterhin hat die Elektronegativität folgende Merkmale:
- Die Elektronegativität ist nicht messbar.
- Die Angabe erfolgt als dimensionslose Zahl, d.h. keine Einheit
- Die Elektronegativität nimmt innerhalb der Periode nach rechts zu.
- Die Elektronegativität nimmt innerhalb einer Gruppe von unten nach oben zu.
Dipolmoleküle
Eine polare Bindung kann zu einem polaren Molekül führen, z.B. bei Wasser oder Wasserstoffchlorid. Fallen die Schwerpunkte der positiven und negativen Teilladungen im Molekül nicht zusammen, besitzt das Molekül einen positiven und negativen Pol. Dieses Molekül nennt man Dipol. Ein Dipol ist dabei aber nach außen hin elektrisch ungeladen.
Beispiel: Wasser
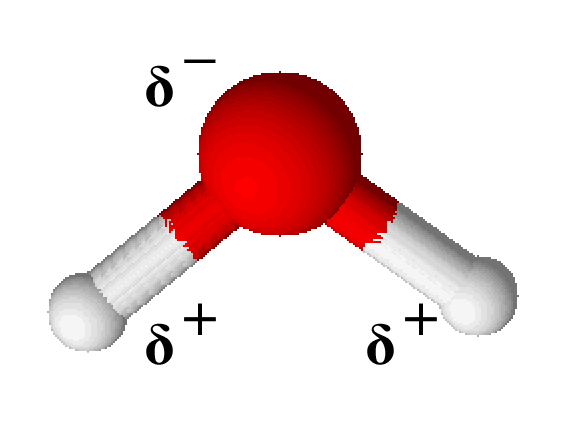
Betrachtet man ein Wassermolekül, erkennt man, dass die Wasserstoffatome am Sauerstoff nicht in einer Linie gebunden sind, sondern dass sie aneinander gedrängt werden. Dies liegt daran, dass der Sauerstoff noch zwei Orbitale besitzt, die an keiner Elektronenbindung beteiligt sind.
Vergleicht man nun die Elektronegativitätswerte von Sauerstoff und Wasserstoff, stellt man fest, dass ersterer einen Wert von 3,4 und letzterer einen Wert von 2,2 besitzt. Damit zieht das Sauerstoffatom die an der kovalenten Bindung beteiligten Elektronen stärker an.
Durch die asymmetrische Form des Wassermoleküls fällt auch der negative Pol nicht mit dem positiven zusammen. Dadurch entsteht ein Dipol, bei dem das Sauerstoffatom als $ \delta^- $ (sprich: „delta minus“) und die Wasserstoffatome als $ \delta^+ $ (sprich: „delta plus“) bezeichnet werden.
Beispiel: Kohlenstoffdioxid
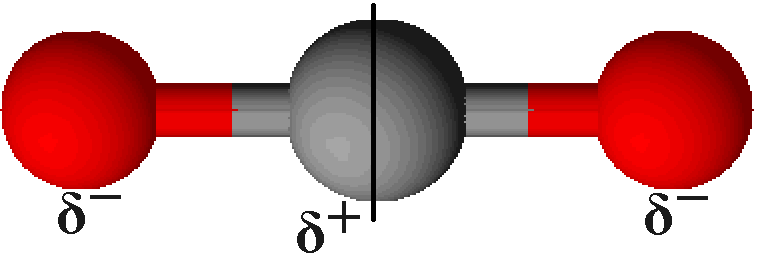
Nimmt man im Vergleich zum Wasser das Molekül des Kohlenstoffs, sieht man, dass auch hier ein Atom (das Kohlenstoff) mit zwei weiteren, gleichen Atomen (Sauerstoff) verbunden ist. Ein wesentlicher Unterschied liegt jedoch bei Struktur vor: Die Sauerstoffatome können (gedacht) mit einer Linie, die durch das Kohlenstoffatom geht, verbunden werden.
Dies lässt sich damit erklären, dass das Kohlenstoffatom mit jedem Sauerstoffatom eine Doppelbindung eingeht. Dadurch besitzt jenes keine freien Valenzelektronen mehr. Nach dem uns bereits bekannten Elektronenabstoßungsmodell lagern sich die Sauerstoffatome dann möglichst weit entfernt voneinander an das Kohlenstoff, sodass sich ein Bindungswinkel von 180° bildet.
Bei der Betrachtung der Elektronegativitäten hat das Kohlenstoff einen Wert von 2,0, während Sauerstoff 3,4 hat (vgl. oben). Daher ziehen hier die Sauerstoffatome die Elektronen wesentlich stärker an sich als das Kohlenstoffatom. Jedoch bildet sich kein Dipol aus, da durch die Symmetrie des Kohlenstoffdioxids die beiden Bindungspolaritäten genau entgegengesetzt gerichtet sind. Durch die Addition dieser Vektoren ergibt sich ein Wert von 0.
Beispiel: Tetrachlorkohlenstoff
Bei dem Molekül Tetrachlorkohlenstoff CCl4 verhält es sich ebenso: Hier liegt ein symmetrischer Molekülbau vor, bei dem das Kohlenstoffatom in der Mitte und die Chloratome an den Ecken eines gedachten Tetraeders liegen; die Addition der Vektoren ergibt 0.
Zwischenmolekulare Kräfte
Zwischenmolekulare Kräfte sind die Kräfte, die zwischen einzelnen Molekülen wirken. Diese Kräfte haben eine große Bedeutung, da man mit ihnen die Aggregatszustände, die Zustandsänderungen, Lösungsvorgänge und Stoffeigenschaften erklären kann.
Betrachtet man Eis, Wasser und Wasserdampf erkennt man, dass immer H2O-Moleküle vorliegen, die sich nur in ihrer Anordnung zueinander unterscheiden, während die Moleküle an sich unverändert bleiben. Man darf daher zwei verschiedene Kraftformen nicht verwechseln:
- Intramolekulare Kräfte: Bestimmen den Aufbau eines Moleküls; sie entstehen durch Elektronenpaarbindungen.
- Zwischenmolekulare Kräfte (auch intermolekulare Kräfte genannt): Bestimmen die Anordnung der Moleküle zueinander, z.B. die Anziehungskräfte zwischen Dipolmolekülen.
Zwischenmolekulare Kräfte sind damit Anziehungskräfte, die Moleküle untereinander ausüben. Davon gibt es mehrere Formen.
Wasserstoffbrückenbindungen
Wasserstoffbrückenbindungen (auch als Wasserstoffbrücken bezeichnet) bilden sich zwischen einem stark positiv polarisierten Wasserstoffatom und einem stark negativ polarisierten Atom mit einem freien Elektronenpaar eines benachbarten Moleküls aus (z. B. F2, Cl2, O2, N2).
Wasserstoffbrückenbindungen sind schwächer als Elektronenpaarbindungen und haben eine größere Bindungslänge. Um eine Wasserstoffbrückenbindung zu spalten, benötigt man viel weniger Energie als für die Spaltung einer Atombindung.
Wasserstoffbrücken spielen beim Aufbau von Körpern in der Biologie eine wichtige Rolle:
- Proteine sind Makromoleküle; Wasserstoffbrückenbindungen stabilisieren diese Moleküle. Enzyme sind Proteine oder haben einen Proteinanteil. Werden Wasserstoffbrücken im Enzymmolekül verändert, so kann es nicht mehr seine Aufgabe erfüllen.
- Die DNA wird in ihrem Aufbau durch Wasserstoffbrücken stabilisiert.
Van-der-Waals-Kräfte
Allgemeines
Auch zwischen unpolaren Molekülen wirken schwache Anziehungskräfte. So werden z.B. Wasserstoff oder Methan bei sehr tiefen Temperaturen flüssig und fest. Für die Ausbildung eines Feststoffgitters müssen zwischenmolekulare Anziehungskräfte wirken.
Diese Moleküle sind sie ihrem Aufbau entsprechend grundsätzlich unpolar. Bei genauer Betrachtung kann man jedoch feststellen, dass das bindende Elektronenpaar nicht immer symmetrisch zwischen den Atomkernen verteilt ist. Dadurch entsteht ein sogenannter spontaner Dipol. Ein solcher bewirkt, dass benachbarte unpolare Moleküle ebenfalls zu Dipolen werden, die als induzierte Dipole bezeichnet werden.
Vergleich zwischen einem permanenten Dipol und einem spontanen/induzierten Dipol
| permanenter Dipol | induzierter/ |
|
| Benennung | Dipol-Dipol-Wechselwirkungen; wenn Wasserstoffatome an andere Atome eines anderen Moleküls gebunden sind, nennt man diese Kräfte Wasserstoffbrückenbindungen | Van-der-Waals-Kräfte |
| Ursache | Unterschiedliche Elektronegativität zwischen den Atomen im Molekül | asymmetrische Anordnung des bindenden Elektronenpaares bzw. kurzzeitiger Einfluss benachbarter Dipole |
| Stärke | teilweise starke zwischenmolekulare Kräfte | Dauer und Stärke der Polarität ist klein |
Van-der-Waals-Kräfte beruhen auf kurzzeitiger und räumlich ständig wechselnden Anziehungen zwischen spontanen und induzierten Dipolen. Mit steigender Molekülgröße und -masse nimmt auch die Stärke der Van-der-Waals-Kräfte zu, da hier die Wahrscheinlichkeit einer asymmetrischen Verteilung größer ist.
Zwischenmolekulare Kräfte und Stoffeigenschaften
Wie bereits erwähnt, kann man mithilfe der intermolekularen Kräfte Stoffeigenschaften erklären.
Schmelz- und Siedetemperaturen
Die Siede- und Schmelztemperatur ist abhängig von der Stärke der zwischenmolekularen Kräfte und diese wiederum von der Polarität des Moleküls und dessen Elektronenzahl.
Nimmt man zum Beispiel die Reihe der Alkane, haben die ersten Moleküle (Methan, Ethan, Propan, Butan) bei Raumtemperatur einen gasförmigen Aggregatszustand. Pentan hingegen ist schon aufgrund seiner Elektronenzahl und Größe flüssig.
Hydratation
Dies ist die Ausbildung einer Hydrathülle, also die Umhüllung von Ionen oder polaren Molekülen mit Dipolmolekülen des Wassers. Dabei lagern sich die Wassermoleküle so an den Stoff an, dass positive und negative Pole einander zugewandt sind.
Lösungsvorgang
Beim Lösungsvorgang treten mehrere Schritte auf:
- Trennung der Ionen eines Salzes (Dissoziation)
- Wasserstoffbrückenbindungen zwischen den Lösungsmittelmolekülen (H2O) werden getrennt
- Wassermoleküle lagern sich um die abgetrennten Ionen an.
Löslichkeit
Die Löslichkeit L gibt an, welche Masse eines Stoffes in einer H2O-Portion von 100 g (= 100 ml) bei einer bestimmten Temperatur vollständig gelöst werden kann.