- Qualitative Analysemethoden
- Nachweisreaktion von Chloridionen
- Flammenfärbung
- Absorption und Emission – die Spektralanalyse
- Absorption
- Emission
- Farbreaktionen
- Nachweise mit Thiocyanat und mit Ammoniak
- Nachweis von Stärke
- Quantitative Aspekte chemischer Reaktionen
- Die Masse von Atomen
- Allgemeines
- Berechnung der Molekül- und Formelmasse
- Atommassen
- Molekülmassen
- Formelmassen
- Umformung von Atom-, Molekül- und Formelmassen in Gramm
- Teilchenzahl und Stoffmenge
- Molare Massen, molare Teilchenzahl und molares Volumen
- Energiebilanzen bei chemischen Reaktionen
- Innere Energie
- Arbeit
- Energie der Salzbildung
- Einzelschritte der Salzbildung
- Energiebetrachtung
- Der räumliche Bau von Molekülen
- Das Orbitalmodell
- Beispiel: Wasserstoff und Helium
- Benennung der Orbitale:
- Pauling-Schreibweise
- Einführung
- Beispiele
- Molekülorbital
- Molekülgeometrie
- Warum können Elektronen Paare bilden?
- Abweichungen vom Tetraederwinkel 109,5°
- Mehrfachbindungen
- Zusammenfassung
- Stereochemie
- Überblick Molekülformeln
- Die polare Atombindung
- Beispiel: Wasserstoffchlorid-Molekül
- Ursache der polaren Atombindung
- Dipolmoleküle
- Beispiel: Wasser
- Beispiel: Kohlenstoffdioxid
- Beispiel: Tetrachlorkohlenstoff
- Zwischenmolekulare Kräfte
- Wasserstoffbrückenbindungen
- Van-der-Waals-Kräfte
- Allgemeines
- Vergleich zwischen einem permanenten Dipol und einem spontanen/induzierten Dipol
- Zwischenmolekulare Kräfte und Stoffeigenschaften
- Schmelz- und Siedetemperaturen
- Hydratation
- Lösungsvorgang
- Löslichkeit
- Säure-Base-Reaktionen
- Saure Lösungen
- Eigenschaften saurer Lösungen
- Wichtige Säuren
- Warum ist eine Lösung sauer?
- Reaktionsgleichung
- Zusammenfassung
- Kategorisierung der Säuren
- Basische Lösungen
- Eigenschaften von Laugen
- Warum ist eine Lauge basisch?
- Weitere Laugen
- Bildung von Säuren und Laugen
- Entstehung einer Säure
- Laugenbildung
- Säure-Base-Definition nach Brönsted und Protolyse
- Beispiel: Reaktion von Chlorwasserstoff mit Wasser
- Ampholyte
- Protolysen in wasserfreier Umgebung
- Indikatoren
- Definition
- Wie erfüllt ein Indikator seine Aufgabe?
- Überblick wichtiger Indikatoren
- Die pH-Skala und die pOH-Skala
- Die Neutralisation
- Redoxreaktionen
- Beispiel
- Oxidationszahl
- Anwendungen von Redoxreaktionen
- Elektrolyse
- Elektrochemische Stromerzeugung in Batterien und Akkus
- Brennstoffzelle
Qualitative Analysemethoden
Um die Zusammensetzung unbekannter Stoffe ermitteln zu können, benötigt man Nachweisreaktionen. Sie sollen möglichst eindeutig und damit unverwechselbar sein. Die qualitative Analytik beschäftigt sich also mit der Frage „Woraus besteht der Stoff?“
Im Gegensatz dazu klärt die quantitative Analytik die Frage „Wie viel ist vom Stoff vorhanden?“
Nachweisreaktion von Chloridionen
Möchte man zum Beispiel in Mineralwasser überprüfen, ob Chloridionen vorhanden sind, kann man mit einer Silbernitratlösung (AgNO3) arbeiten. Das Nachweisreagenz reagiert mit den Chloridionen zu einem weißen Niederschlag, dem Silberchlorid (AgCl):
Flammenfärbung
Eine Möglichkeit Alkali- und Erdalkalimetallverbindungen nachzuweisen ist die Flammenfärbung. Dabei treten unterschiedlich gefärbte Flammen auf, die einem Element zugeordnet werden können.
Dies ist möglich, da die Elektronen durch die Energiezufuhr auf eine energiereichere Schale wandern und gleich wieder zurückfallen. Dabei wird eine bestimmte Menge an Energie in Form von Photonen frei, die durch eine bestimmte Farbe sichtbar wird.
Absorption und Emission – die Spektralanalyse
Absorption
Bestrahlt man einen Gegenstand mit weißem Licht, so absorbiert („schluckt“) dieser einen Teil des Lichts. Beim Absorptionsspektrum bilden sich daher einige schwarze Linien.
Emission
Bei der Emission betrachtet man das Licht, das eine Substanz ausstrahlt, wenn man ihr genug Energie zuführt. Beim Emissionsspektrum erkennt man farbige Linien, die den schwarzen Linien der Absorption entsprechen.
Farbreaktionen
Bei Farbreaktionen können Bestandteile von Verbindungen nachgewiesen werden. Dabei bilden die nachzuweisenden Teilchen und das Nachweisreagenz einen farbigen Stoff.
Nachweise mit Thiocyanat und mit Ammoniak
Eisen(III)-Ionen können in einer Reaktion mit Thiocyanationen (SCN–), nachgewiesen werden. Dabei so entsteht eine intensiv rot gefärbte Lösung.
Kupfer(II)-Ionen bilden mit Ammoniak in einer wässrigen Lösung eine dunkelblaue Verbindung. Ammoniak ist damit ein Nachweisreagenz für Kupfer.
Nachweis von Stärke
Eine wichtige Farbreaktion ist die Iod-Stärke-Reaktion. Sie spielt besonders bei der Prüfung von Lebensmitteln auf Stärke eine Rolle. Mit Stärke reagiert Iod-Kalium-Iodid, die sogenannte Lugolsche Lösung zu einer intensiv blau bzw. violett gefärbten Lösung.
Quantitative Aspekte chemischer Reaktionen
Chemische Reaktionen führen zu einer Stoffveränderung und zu einem Energieumsatz. Wichtig ist aber auch die Frage, wie viele Teilchen bei einer Reaktion reagieren. Dies kann man beantworten, indem man die benötigten Eduktmengen genau einwiegt, wodurch die Produktmengen berechenbar werden.
Die Masse von Atomen
Allgemeines
Da die Atome eine zu kleine Masse besitzen, um sie mit Kilogramm oder Gramm anzugeben, wurde der Begriff der „relative Atommasse“ eingeführt. Seit 1961 ist das Kohlenstoffisotop 12C die Bezugsbasis; es hat den Wert 12.
Die relative Atommasse gibt also an, wie groß die Masse eines Atoms im Vergleich zu einem Zwölftel der Masse des Kohlenstoffisotops 12C ist.
Untersucht man mithilfe der Massenspektroskopie das 12C, so erhält man dessen Masse von
Da eine Angabe in (Kilo)Gramm zu unpraktisch ist, definierte man die neue Einheit atomare Masseneinheit. Sie wird in $ \mathrm{u} $ angegeben. $ \mathrm{1\,u} $ beträgt ebenfalls ein Zwölftel der Atommasse von 12C; der genaue Wert beträgt somit
Berechnung der Molekül- und Formelmasse
Atommassen
Atommassen bzw. deren Mittelwerte können im Periodensystem nachgelesen werden. So hat Sauerstoff eine Atommasse von 15,994 u. Die Atommasse wird mit $ m_a $ abgekürzt. Die Angabe der Masse von zum Beispiel Stickstoff erfolgt auf folgende Weise:
Molekülmassen
Molekülmassen werden berechnet, indem man die Atommassen addiert und die Indices der Molekülformel als Faktoren miteinbezieht. Als Abkürzung dient $ m_M $:
Formelmassen
Formelmassen $ m_F $ werden wie Molekülmassen ermittelt:
Umformung von Atom-, Molekül- und Formelmassen in Gramm
Ein Gramm beträgt $ 6{,}022 \cdot 10^{23}\,\mathrm{u} $.
Teilchenzahl und Stoffmenge
Möchte man wissen, wie viele Atome in einer bestimmten Stoffportion enthalten sind, so nimmt man die Masse des Stoffes und teilt durch dessen Atommasse. Das Ergebnis ist die Teilchenzahl $ N $:
Nimmt man als Masse einer Stoffportion immer die Atommasse in Gramm (bei molekularen Stoffen die Molekülmasse in Gramm), so erhält man für diese Massen immer die gleiche Zahl von Teilchen (Atome oder Moleküle).
Die Stoffportion, die 6,022 · 1023 Teilchen (Atome oder Moleküle) enthält, definiert man als $ n = \mathrm{1\,mol} $. Dies ist die sogenannte Stoffmenge.
Molare Massen, molare Teilchenzahl und molares Volumen
Die Masse einer Stoffportion mit der $ n = \mathrm{1\,mol} $ entspricht also immer der Atommasse $ m_a $, der Molekülmasse $ m_M $ und der Formelmasse $ m_F $ in Gramm. Sie heißt molare Masse $ M $ und ist der Quotient aus der Masse $ m $ und der Stoffmenge $ n $:
Die Stoffmenge $ n $ und daraus die abgeleitete Molare Masse $ M $ sind die zentralen Begriffe, um Berechnungen in der Chemie einfach gestalten zu können. Die Teilchenzahl $ N $ eines Stoffes ist mit dessen Stoffmenge $ n $ verknüpft. Diesen Proportionalitätsfaktor $ N_A $ nennt man Avogadro-Konstante.
$ N_A $ gibt also immer die Teilchenzahl in einem Mol des Stoffes an und beträgt
Für Gase kann man schließlich noch eine Beziehung zwischen der Stoffmenge n und dem molaren Volumen $ V_M $ herleiten:
Energiebilanzen bei chemischen Reaktionen
Bei chemischen Reaktionen gibt es verschiedene Systeme:
- offenes System: Energie- und Stoffaustausch mit der Umwelt
- geschlossenes System: nur Energie-, kein Stoffaustausch
- isoliertes System: kein Stoff- und kein Energieaustausch
Innere Energie
Die innere Energie eines Systems wird dabei in verschiedenen Formen frei:
- Lichtenergie
- elektrische Energie
- Wärmeenergie
- mechanische Energie
Die innere Energie eines Systems kann nicht direkt gemessen werden. Bei chemischen Reaktionen lassen sich nur die Änderungen der $ E_i $ messen. Die Änderung wird über das griechische Delta $ \Delta $ gekennzeichnet:
Arbeit
Chemische Reaktionen leisten auch Arbeit. Beispiele sind unter anderem:
- Motor: Er leistet mechanische Arbeit; der Motor wird dabei heiß; das bedeutet, es wird Reaktionswärme freigesetzt
- Stopfen: Dieser wird durch ein entstehendes Gas weggedrückt; es findet also eine Volumenvergrößerung statt; damit verrichtet Gas Volumenarbeit; es wird Volumenarbeit $ W $ gegen den Luftdruck $ p $ geleistet: $ W = -p \cdot \Delta V $
Die Reaktionswärme $ Q $ und Volumenarbeit $ W $ ergeben den Energiebetrag, der der Änderung der inneren Energie entspricht:
Bei der Ermittlung der Reaktionsenergie ist die Volumenarbeit im Vergleich zur Reaktionswärme $ Q $ bei den meisten Reaktionen vernachlässigbar klein.
Energie der Salzbildung
Einzelschritte der Salzbildung
Betrachtet man die Energie bei der Salzbildung, zum Beispiel der Bildung von Kalium und Chlor zu Kaliumchlorid, muss man die Bildung des Salzes in Einzelschritte unterteilen. In diesem Beispiel sieht dies wie folgt aus:
- Kalium kann sich nur mit Chlor verbinden, wenn sich die Kaliumatome aus dem Metallgitter lösen und mit dem (biatomaren) Chlormolekül in Kontakt kommen.
- Diese Chlormoleküle müssen in die Chloratome gespalten werden.
- Erst dann können die Kaliumatome jeweils ein Elektron an die Chloratome übertragen: Sie sind damit die Elektronendonatoren und die Chloratome die Elektronenakzeptoren; Der Elektronenübergang führt zu den entsprechenden Ionen
- Die Kalium- und Chloridionen lagern sich zu einem Ionengitter zusammen, welches durch elektrostatische Kräfte zusammengehalten wird.
Energiebetrachtung
Bei den einzelnen Schritten wird eine bestimmte Energie umgesetzt.
- Lösen der Kaliumatome aus dem Metallgitter: Sublimationsenergie
- Spaltung der Chlormoleküle in Chloratome: Dissoziationsenergie
- Elektronenabgabe bei Kaliumatomen: Ionisierungsenergie
- Elektronenaufnahme bei Chloratomen: Elektronenaffinität (Energie wird frei)
- Zusammentreten der Kalium- und Chloridionen: Gitterenergie
Der räumliche Bau von Molekülen
Das Orbitalmodell
Für Elektronen lassen sich mathematisch sogenannte Aufenthaltsräume berechnen. Der Bereich, in dem sich ein Elektron mit hoher Wahrscheinlichkeit befindet, nennt man Orbital. Bei diesen Berechnungen erhält man auch die Orbitalform.
Beispiel: Wasserstoff und Helium
Das Atomorbital eines Wasserstoffelektrons ist kugelförmig. Nach außen wird die Wahrscheinlichkeit das Elektron anzutreffen immer geringer. Das Orbital ist nach außen hin nicht scharf begrenzt.
Beim Heliumatom sind zwei energetisch gleiche Elektronen vorhanden. Beide Elektronen befinden sich im selben Orbital wie das eine Elektron vom Wasserstoffatom.
Es gibt zahlreiche Orbitalformen, z.B. ein hantelförmiges Orbital, die bei Elementen ab der 2. Periode vorhanden sind. Von diesen hantelförmigen Orbitalen gibt es jeweils drei, die entlang der drei Raumachsen liegen.
Benennung der Orbitale:
Durch Berechnung erhält man unterschiedlich geformte Orbitale. Das kugelförmige Orbital wird s-Orbital, das hantelförmiges Orbital p-Orbital genannt.
S- und p-Orbitale gibt es in jeder Periode; damit man sie unterscheiden kann, setzt man die Nummer der Energiestufe voran. So wird das s-Orbital der 1. Periode als 1s-Orbital genannt und das s- oder p-Orbital der 2. Periode 2s-Orbital bzw. 2p-Orbital.
Pauling-Schreibweise
Einführung
Zur einfachen Übersicht für das „Auffüllen“ der Orbitale kann die Pauling-Schreibweise (auch Kästchenschreibweise genannt), benutzt werden. Dabei stellt ein Kästchen ein Orbital dar. Die Elektronen werden mit einem Pfeil dargestellt; die Richtung gibt dabei den Spin an.
Beim Ausfüllen (allgemein) sind folgende zwei Regeln zu beachten: Zunächst sind energieärmere Orbitale zu besetzen. Energiegleiche Orbitale sind dabei zuerst halb auszufüllen und anschließend doppelt.
Bei der Pauling-Schreibweise werden die energieärmsten Orbitale nach unten geschrieben. In der gleichen „Schale“ ist das s-Orbital dabei energieärmer als das p-Orbital.
Beispiele
An einigen Beispielen soll dies verdeutlicht werden:
Molekülorbital
Die beiden Atome eines Wasserstoffmoleküls werden durch eine Atombindung zusammengehalten; die Bindung über die beiden Elektronen der Wasserstoffatome nennt man Elektronenpaarbindung oder kovalente Bindung. Die Elektronen stammen aus einfach besetzten Atomorbitalen.
Ein Molekülorbital kann zwischen Wasserstoffatomen nur entstehen, wenn sich die beiden Orbitale gegenseitig durchdringen (sogenannte Überlappung). Es kommt zur Ausbildung eines gemeinsamen Orbitals, das Molekülorbital genannt wird.
Zwischen den Kernen herrschen Abstoßungskräfte; dadurch können sie sich nicht beliebig nähern. Bevorzugter Aufenthaltsbereich der Elektronen ist der Überlappungsbereich, wodurch hier eine erhöhte negative Ladungsdichte herrscht.
Moleküle wie Wasserstoff, Chlor, Hydrogenchlorid (HCl) oder Wasser sind energieärmer als die getrennten Atome, deshalb bilden sie sich aus diesen Atomen. Im Molekül erreichen die gebundenen Atome die Elektronenkonfiguration eines Edelgases (Oktettregel).
Molekülgeometrie
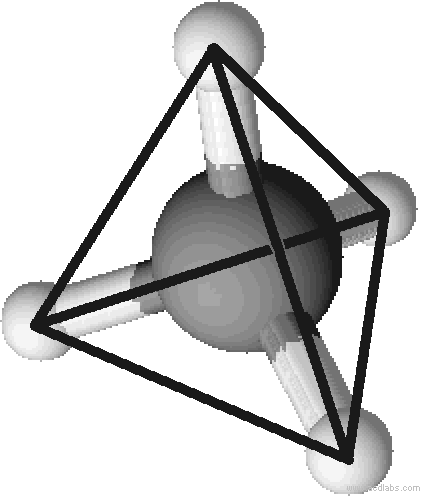
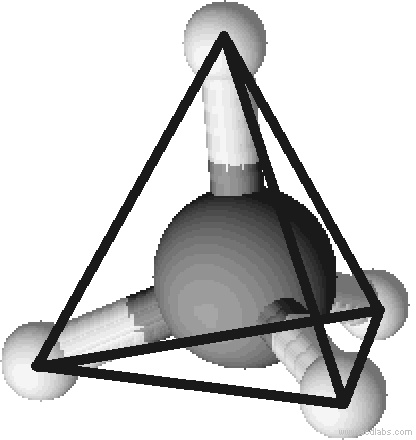
Um die Bindungsverhältnisse zwischen zwei oder mehreren Atomen darzustellen, z.B. für ein Molekül, eignet sich besonders gut die Valenzstrichformel. Mit dieser schaut Methan (CH4) wie auf der rechten Seite aus.
Die Valenzstrichformel sagt aber nichts über die räumliche Gestalt eines Moleküls aus. So könnte man denken, dass alle fünf Atome in einer Ebene liegen, das Molekül also planar gebaut wäre. Messungen ergeben jedoch, dass eine tetraedrische Struktur vorliegt: Die vier Wasserstoffatome befinden sich an den Ecken eines (gedachten) Tetraeders, das Kohlenstoffatom liegt im Zentrum jenes. Der Bindungswinkel zwischen den einzelnen Atomen beträgt dabei 109,5°.
Warum können Elektronen Paare bilden?
Elektronen können in einem Orbital alleine oder mit einem anderen Elektron vorkommen. Sie stoßen sich jedoch aufgrund ihrer gleichartigen elektrischen Ladung ab. Trotz dieses „Abstoßungseffekts“ ist dies möglich. Er wird nämlich durch den so genannten Spin (oder Eigendrehimpuls) des Elektrons überlagert.
Elektronen können in dieser Eigenrotation gleich oder verschieden sein. Ein entgegengesetzter Spin mindert die Abstoßung. So können sich spinverschiedene Elektronen nähern und Elektronenpaare in einem Orbital bilden.
Die Elektronen in einem Orbital sind trotz ihres verschiedenen Spins dennoch energetisch gleich. Damit treten die acht Elektronen der Elektronenkonfiguration als vier Elektronenpaare in vier Orbitalen auf.
Nach dem Elektronenabstoßungsmodell (EPA-Modell) kann folgende Aussage gemacht werden: Die Elektronen verhalten sich so, als ob sie einander abstoßen würden und ordnen sich daher in möglichst großer Entfernung voneinander an.
Abweichungen vom Tetraederwinkel 109,5°
Vergleicht man ein Methanmolekül mit einem Ammoniakmolekül (NH3), erkennt man folgende Unterschiede:
- Methan: 4 bindende Elektronenpaare, Bindungswinkel 109,5°
- Ammoniak: 3 bindende Elektronenpaare, 1 freies Elektronenpaar, Bindungswinkel 107,3°
Den Unterschied im Bindungswinkel kann damit erklären, dass das Orbital eines nicht bindenden Elektronenpaares einen größeren Raum einnimmt als ein bindendes. Dadurch werden diese aneinander gedrängt und der Bindungswinkel wird kleiner.
Mehrfachbindungen
Mehrfachbindungen kommen dann zwischen zwei Atomen zustande, wenn ein Atom einem anderen nicht nur ein halb besetztes Orbital zur Ausbildung einer Bindung anbieten kann, sondern zwei oder drei solcher Orbitale.
Dies kann man gut an den beiden biatomaren Elementen Sauerstoff und Stickstoff erkennen.
- Sauerstoff: Hier gibt es zwei halb besetzte Orbitale für eine Bindungsbildung, das heißt zwischen zwei Sauerstoffatomen besteht eine Doppelbindung (wodurch beide Atome den Oktettzustand erreichen).
- Stickstoff: Es gibt drei halb besetzte Orbitale und damit eine Dreifachbindung. Auch hier erreichen beide Atome den Edelgaszustand.
Die Molekülorbitale einer Mehrfachbindung brauchen nicht mehr Raum als eine Einfachbindung. Daher werden hier die anderen Orbitale nicht aneinander gedrängt. Betrachtet man zum Beispiel das Kohlenstoffdioxidmolekül, erkennt man, dass ein linearer Bau mit einer Doppelbindung und einem Bindungswinkel von 180° vorliegt.
Zusammenfassung
Um den räumlichen Bau von Molekülen darzustellen, bedient man sich folgender Regeln:
- Elektronenpaare stoßen sich gegenseitig ab und bilden den jeweils größtmöglichen Winkel untereinander.
- Nicht bindende Elektronenpaare benötigen mehr Raum als bindende.
- Mehrfachbindungen werden in ihrer abstoßenden Wirkung wie Einfachbindungen behandelt.
Stereochemie
In der Stereochemie wird die dreidimensionale Struktur der Moleküle untersucht. Die Struktur eines Moleküls hat einen Einfluss auf die Stoffeigenschaften und den Ablauf chemischer Reaktionen.
Nimmt man wieder das Methan, so konnte man nachweisen, dass dieses eine Tetraederstruktur besitzt, da es nur ein Chlormethan-Molekül (CH3Cl) existiert. Von diesem Molekül sind die planare und die tetraedrische Struktur denkbar. Jedoch konnte bewiesen werden, dass es die planare Anordnung nicht gibt (CH2Cl2).
Überblick Molekülformeln
Für eine Übersicht über die verschiedenen Möglichkeiten der Darstellung eines Stoffs soll hier eine Verbindung aus der organischen Chemie dienen: Buttersäure = Butansäure.
| Formelschreibweise | Erklärung/Verwendungszweck | Darstellung der Butansäure |
| Summenformel | bei Molekülen auch Molekülformel genannt; sie zeigt die exakte atomare Zusammensetzung eines Moleküls und wird zum Erstellen einer Reaktionsgleichung genutzt | $ \mathrm{C_4H_8O_2} $ |
| Konstitutionsformel | sie gibt die Verknüpfung der Atome in einer übersichtlichen Schnellschreibweise an | $ \mathrm{C_3H_7COOH} $ |
| Halbstrukturformel | genaue Angabe zur Verknüpfung der Atomgruppen in übersichtlicher Schnellschreibweise | |
| Strukturformel | exakte Darstellung der Verknüpfung der Atome und der nicht bindenden Elektronenpaare; benötigt man zur Darstellung von Reaktionsmechanismen |
Die polare Atombindung
Bisher sind folgende Bindungstypen bekannt: Die Ionenbildung, die bei Salzen vorkommt (z.B. NaCl), und die Elektronenpaarbindung bei Molekülen wie H2 oder Cl2. Bei den meisten Verbindungen liegen die tatsächlichen Bindungsverhältnisse aber zwischen diesen beiden Typen.
Beispiel: Wasserstoffchlorid-Molekül
Beim Wasserstoffchlorid-Molekül (HCl) liegt eine Elektronenpaarbindung vor. Allerdings wird die bindende Elektronenpaarbindung vom Chloratom stärker angezogen als vom Wasserstoffatom. Man sagt, dass das Chloratom elektronegativer ist.
Elektronegativität ist daher die Fähigkeit eines Atoms, die Elektronen innerhalb einer Elektronenpaarbindung an sich zu ziehen.
Aus dem Atomorbital des Wasserstoffatoms und dem des Chloratoms wird ein unsymmetrisches Molekülorbital gebildet. Die negative Ladung ist ungleichmäßig verteilt.
Ursache der polaren Atombindung
Je höher die Kernladungszahl ist und je näher ein Elektron am Kern ist, desto stärker zieht ein Atom die Elektronenpaare an. Um die einzelnen Atome vergleichen zu können, wurde den Elementen von Linus Pauling ein Wert zugeordnet. Dieser Wert ist die Elektronegativität $ EN $.
Fluor wird der höchste Wert von 4,0 zugeordnet ($ EN(\text{F}) = 4,0 $). Den niedrigsten hat Lithium mit 1,0. Weiterhin hat die Elektronegativität folgende Merkmale:
- Die Elektronegativität ist nicht messbar.
- Die Angabe erfolgt als dimensionslose Zahl, d.h. keine Einheit
- Die Elektronegativität nimmt innerhalb der Periode nach rechts zu.
- Die Elektronegativität nimmt innerhalb einer Gruppe von unten nach oben zu.
Dipolmoleküle
Eine polare Bindung kann zu einem polaren Molekül führen, z.B. bei Wasser oder Wasserstoffchlorid. Fallen die Schwerpunkte der positiven und negativen Teilladungen im Molekül nicht zusammen, besitzt das Molekül einen positiven und negativen Pol. Dieses Molekül nennt man Dipol. Ein Dipol ist dabei aber nach außen hin elektrisch ungeladen.
Beispiel: Wasser
Betrachtet man ein Wassermolekül, erkennt man, dass die Wasserstoffatome am Sauerstoff nicht in einer Linie gebunden sind, sondern dass sie aneinander gedrängt werden. Dies liegt daran, dass der Sauerstoff noch zwei Orbitale besitzt, die an keiner Elektronenbindung beteiligt sind.
Vergleicht man nun die Elektronegativitätswerte von Sauerstoff und Wasserstoff, stellt man fest, dass ersterer einen Wert von 3,4 und letzterer einen Wert von 2,2 besitzt. Damit zieht das Sauerstoffatom die an der kovalenten Bindung beteiligten Elektronen stärker an.
Durch die asymmetrische Form des Wassermoleküls fällt auch der negative Pol nicht mit dem positiven zusammen. Dadurch entsteht ein Dipol, bei dem das Sauerstoffatom als $ \delta^- $ (sprich: „delta minus“) und die Wasserstoffatome als $ \delta^+ $ (sprich: „delta plus“) bezeichnet werden.
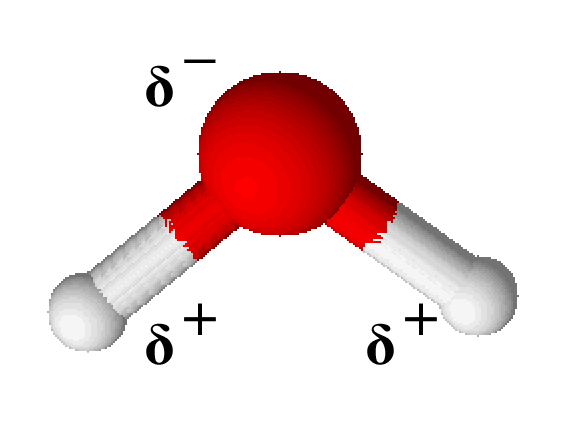
Beispiel: Kohlenstoffdioxid
Nimmt man im Vergleich zum Wasser das Molekül des Kohlenstoffs, sieht man, dass auch hier ein Atom (das Kohlenstoff) mit zwei weiteren, gleichen Atomen (Sauerstoff) verbunden ist. Ein wesentlicher Unterschied liegt jedoch bei Struktur vor: Die Sauerstoffatome können (gedacht) mit einer Linie, die durch das Kohlenstoffatom geht, verbunden werden.
Dies lässt sich damit erklären, dass das Kohlenstoffatom mit jedem Sauerstoffatom eine Doppelbindung eingeht. Dadurch besitzt jenes keine freien Valenzelektronen mehr. Nach dem uns bereits bekannten Elektronenabstoßungsmodell lagern sich die Sauerstoffatome dann möglichst weit entfernt voneinander an das Kohlenstoff, sodass sich ein Bindungswinkel von 180° bildet.
Bei der Betrachtung der Elektronegativitäten hat das Kohlenstoff einen Wert von 2,0, während Sauerstoff 3,4 hat (vgl. oben). Daher ziehen hier die Sauerstoffatome die Elektronen wesentlich stärker an sich als das Kohlenstoffatom. Jedoch bildet sich kein Dipol aus, da durch die Symmetrie des Kohlenstoffdioxids die beiden Bindungspolaritäten genau entgegengesetzt gerichtet sind. Durch die Addition dieser Vektoren ergibt sich ein Wert von 0.
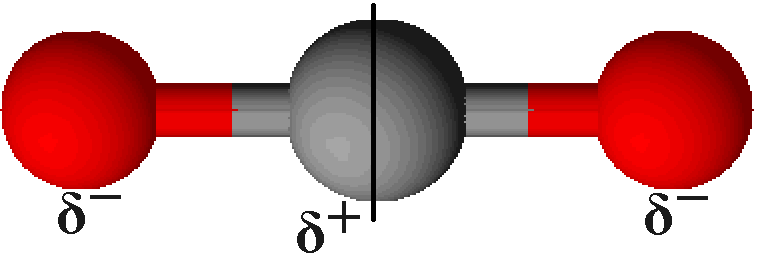
Beispiel: Tetrachlorkohlenstoff
Bei dem Molekül Tetrachlorkohlenstoff CCl4 verhält es sich ebenso: Hier liegt ein symmetrischer Molekülbau vor, bei dem das Kohlenstoffatom in der Mitte und die Chloratome an den Ecken eines gedachten Tetraeders liegen; die Addition der Vektoren ergibt 0.
Zwischenmolekulare Kräfte
Zwischenmolekulare Kräfte sind die Kräfte, die zwischen einzelnen Molekülen wirken. Diese Kräfte haben eine große Bedeutung, da man mit ihnen die Aggregatszustände, die Zustandsänderungen, Lösungsvorgänge und Stoffeigenschaften erklären kann.
Betrachtet man Eis, Wasser und Wasserdampf erkennt man, dass immer H2O-Moleküle vorliegen, die sich nur in ihrer Anordnung zueinander unterscheiden, während die Moleküle an sich unverändert bleiben. Man darf daher zwei verschiedene Kraftformen nicht verwechseln:
- Intramolekulare Kräfte: Bestimmen den Aufbau eines Moleküls; sie entstehen durch Elektronenpaarbindungen.
- Zwischenmolekulare Kräfte (auch intermolekulare Kräfte genannt): Bestimmen die Anordnung der Moleküle zueinander, z.B. die Anziehungskräfte zwischen Dipolmolekülen.
Zwischenmolekulare Kräfte sind damit Anziehungskräfte, die Moleküle untereinander ausüben. Davon gibt es mehrere Formen.
Wasserstoffbrückenbindungen
Wasserstoffbrückenbindungen (auch als Wasserstoffbrücken bezeichnet) bilden sich zwischen einem stark positiv polarisierten Wasserstoffatom und einem stark negativ polarisierten Atom mit einem freien Elektronenpaar eines benachbarten Moleküls aus (z. B. F2, Cl2, O2, N2).
Wasserstoffbrückenbindungen sind schwächer als Elektronenpaarbindungen und haben eine größere Bindungslänge. Um eine Wasserstoffbrückenbindung zu spalten, benötigt man viel weniger Energie als für die Spaltung einer Atombindung.
Wasserstoffbrücken spielen beim Aufbau von Körpern in der Biologie eine wichtige Rolle:
- Proteine sind Makromoleküle; Wasserstoffbrückenbindungen stabilisieren diese Moleküle. Enzyme sind Proteine oder haben einen Proteinanteil. Werden Wasserstoffbrücken im Enzymmolekül verändert, so kann es nicht mehr seine Aufgabe erfüllen.
- Die DNA wird in ihrem Aufbau durch Wasserstoffbrücken stabilisiert.
Van-der-Waals-Kräfte
Allgemeines
Auch zwischen unpolaren Molekülen wirken schwache Anziehungskräfte. So werden z.B. Wasserstoff oder Methan bei sehr tiefen Temperaturen flüssig und fest. Für die Ausbildung eines Feststoffgitters müssen zwischenmolekulare Anziehungskräfte wirken.
Diese Moleküle sind sie ihrem Aufbau entsprechend grundsätzlich unpolar. Bei genauer Betrachtung kann man jedoch feststellen, dass das bindende Elektronenpaar nicht immer symmetrisch zwischen den Atomkernen verteilt ist. Dadurch entsteht ein sogenannter spontaner Dipol. Ein solcher bewirkt, dass benachbarte unpolare Moleküle ebenfalls zu Dipolen werden, die als induzierte Dipole bezeichnet werden.
Vergleich zwischen einem permanenten Dipol und einem spontanen/induzierten Dipol
| permanenter Dipol | induzierter/ |
|
| Benennung | Dipol-Dipol-Wechselwirkungen; wenn Wasserstoffatome an andere Atome eines anderen Moleküls gebunden sind, nennt man diese Kräfte Wasserstoffbrückenbindungen | Van-der-Waals-Kräfte |
| Ursache | Unterschiedliche Elektronegativität zwischen den Atomen im Molekül | asymmetrische Anordnung des bindenden Elektronenpaares bzw. kurzzeitiger Einfluss benachbarter Dipole |
| Stärke | teilweise starke zwischenmolekulare Kräfte | Dauer und Stärke der Polarität ist klein |
Van-der-Waals-Kräfte beruhen auf kurzzeitiger und räumlich ständig wechselnden Anziehungen zwischen spontanen und induzierten Dipolen. Mit steigender Molekülgröße und -masse nimmt auch die Stärke der Van-der-Waals-Kräfte zu, da hier die Wahrscheinlichkeit einer asymmetrischen Verteilung größer ist.
Zwischenmolekulare Kräfte und Stoffeigenschaften
Wie bereits erwähnt, kann man mithilfe der intermolekularen Kräfte Stoffeigenschaften erklären.
Schmelz- und Siedetemperaturen
Die Siede- und Schmelztemperatur ist abhängig von der Stärke der zwischenmolekularen Kräfte und diese wiederum von der Polarität des Moleküls und dessen Elektronenzahl.
Nimmt man zum Beispiel die Reihe der Alkane, haben die ersten Moleküle (Methan, Ethan, Propan, Butan) bei Raumtemperatur einen gasförmigen Aggregatszustand. Pentan hingegen ist schon aufgrund seiner Elektronenzahl und Größe flüssig.
Hydratation
Dies ist die Ausbildung einer Hydrathülle, also die Umhüllung von Ionen oder polaren Molekülen mit Dipolmolekülen des Wassers. Dabei lagern sich die Wassermoleküle so an den Stoff an, dass positive und negative Pole einander zugewandt sind.
Lösungsvorgang
Beim Lösungsvorgang treten mehrere Schritte auf:
- Trennung der Ionen eines Salzes (Dissoziation)
- Wasserstoffbrückenbindungen zwischen den Lösungsmittelmolekülen (H2O) werden getrennt
- Wassermoleküle lagern sich um die abgetrennten Ionen an.
Löslichkeit
Die Löslichkeit L gibt an, welche Masse eines Stoffes in einer H2O-Portion von 100 g (= 100 ml) bei einer bestimmten Temperatur vollständig gelöst werden kann.
Säure-Base-Reaktionen
Eine wichtige Reaktionsart in der Chemie ist die Säure-Base-Reaktion. Um diese zu verstehen, soll zunächst einmal erklärt werden, was eine Säure und was eine Base ist.
Saure Lösungen
Eigenschaften saurer Lösungen
Säuren oder saure Lösungen haben folgende Eigenschaften:
- hohe elektrische Leitfähigkeit
- Magnesium, Zink, Eisen und andere unedle Metalle werden aufgelöst (siehe hier für den Reaktionsmechanismus)
- Nachweis mit Indikatoren
- saurer Geschmack; ätzend und reizend
- reagieren mit Metalloxiden, z.B. Kupfer(II)-oxid (CuO); hier würde eine Lösung von Kupferchlorid (CuCl2) entstehen
Wichtige Säuren
Folgende Säuren sollte (und muss) man kennen, da sie als Grundwissen auch ohne Formelsammlung abgefragt werden können:
- Schwefelsäure: H2SO4
- Schweflige Säure: H2SO3
- Salpetersäure: HNO3
- Salpetrige Säure: HNO2
- Phosphorsäure: H3PO4
- Kohlensäure: H2CO3
- Salzsäure: HCl
- Fluorwasserstoff: HF
Der Begriff Säure wird sowohl für reine Säuren als auch für saure Lösungen verwendet. Der Säuregehalt saurer Lösungen ist bei konzentrierten Säuren hoch, bei verdünnten Säuren niedrig.
Warum ist eine Lösung sauer?
Säuren enthalten ein oder mehrere Wasserstoffatome. Diese können als Proton also als H+-Ion abgegeben werden. Dies lässt sich mithilfe der Elektronegativität erklären.
Nimmt man das Molekül des Wasserstoffchlorids (HCl) und betrachtet die einzelnen EN-Werte, stellt man fest, dass das Chloratom das bindende Elektronenpaar viel stärker anzieht als der Wasserstoff, da das Chlor eine Elektronegativität von 3,2 und Wasserstoff nur 2,2 hat.
Dies führt dazu, dass das Molekül nicht homolytisch gespalten wird, also dass beide Atome „sein“ bindendes Valenzelektron mitnimmt. Stattdessen wird es heterolytisch getrennt. Das bindende Elektronenpaar bleibt dabei beim Säurerest, wodurch sich ein Chloridion ergibt.
Das frei gewordene Proton reagiert dann mit einem Wassermolekül zu einem Oxoniumion (H3O+). Die Konzentration an Oxoniumionen gibt an, wie sauer eine Lösung ist.
Reaktionsgleichung
Die Reaktionsgleichung zu diesem Beispiel lautet wie folgt:
Zusammenfassung
Eine Säure ist ein Teilchen, das Protonen abgeben kann. In einer sauren Lösung befinden sich stets Oxoniumionen sowie der Säurerest.
Kategorisierung der Säuren
Die Säuren werden nach ihrer Möglichkeit, Protonen abzugeben, benannt:
- einprotonige Säuren: Sie sind in der Lage, ein Proton abzuspalten, z.B. HCl, HNO3.
- zweiprotonige Säuren: Sie können zwei Protonen abgeben, u.a. H2SO4, H2CO3.
- dreiprotonige Säuren: Sie können bis zu drei Protonen abspalten, z.B. H3PO4.
Weiterhin gibt es die Einteilung in einwertige Säuren und mehrwertige Säuren. Sie erfolgt auf die gleiche Art.
Basische Lösungen
Laugen sind basische Lösungen. Die bekanntesten Laugen sind die Natronlauge (NaOH) und die Kalilauge (KOH).
Eigenschaften von Laugen
Basische Lösungen haben folgende Eigenschaften:
- seifige/schmierige Wirkung (direkter Kontakt gefährlich!)
- ätzend (je nach Stärke)
- Nachweis mit Indikatoren
- Basische Lösungen zeigen eine erhöhte Leitfähigkeit
Warum ist eine Lauge basisch?
Kalilauge und Natriumlauge sind beide Salze. Gibt man sie in Wasser, werden beim Lösen die Ionen frei beweglich. Die Konzentration an OH–-Ionen, welche als Hydroxidionen bezeichnet werden, gibt dabei an, wie basisch eine Lösung ist. Die Reaktionsgleichung lautet:
Weitere Laugen
Weitere wichtige Laugen sind:
- Calciumhydroxidlösung (auch Kalkwasser genannt): Ca(OH)2
- Bariumhydroxidlösung: Ba(OH)2
Bildung von Säuren und Laugen
Im Folgenden soll darauf eingegangen werden, wie Säuren und Laugen gebildet werden.
Entstehung einer Säure
Säuren erhält man, wenn Nichtmetalloxide mit Wasser reagieren. Leitet man zum Beispiel die Oxide des Schwefels Schwefeldioxid (SO2) und Schwefeltrioxid (SO3) in Wasser ein, bilden sich die schweflige Säure und die Schwefelsäure:
Auch bei anderen Nichtmetalloxiden führt die Reaktion mit Wasser zu einer Säure:
Dies stellt ein Problem für die Umwelt dar: Werden fossile Brennstoffe wie Erdöl oder Kohle verbrannt, entstehen Gase (z.B. Kohlenstoffdioxid). Diese reagieren dann aber mit dem Wasser. Dies ist der so genannte Saure Regen, der zu Waldsterben führen kann.
Laugenbildung
Alkali- und Erdalkalimetalle reagieren mit Wasser. Dabei entsteht jeweils die entsprechende Lauge und es wird Wasserstoff freigesetzt.
Ebenso können die löslichen Metalloxide von Alkali- und Erdalkalimetallen reagieren.
Säure-Base-Definition nach Brönsted und Protolyse
Der dänische Chemiker und Physik Johannes Nicolaus Brønsted (1879-1947) definierte 1923 eine Säure als ein Protonendonator und eine Base als Protonenakzeptor. Den Übergang eines Protons von einem Teilchen auf ein anderes wird Protolyse genannt.
Beispiel: Reaktion von Chlorwasserstoff mit Wasser
Leitet man das Gas Chlorwasserstoff (HCl) in Wasser ein, wird jenes heterolytisch gespalten. Das frei werdende Proton reagiert mit dem Wasser zu einem Oxoniumion; das Chloridion reagiert nicht weiter. Der Chlorwasserstoff ist daher der Protonendonator und das Wasser der Protonenakzeptor.
Ampholyte
Bei der Reaktion von Carbonationen (CO32–) und Wasser entstehen Hydroxidionen und Hydrogencarbonationen (HCO3–).
Wasser reagiert hier also als Säure. Es kann also – je nach der Reaktionsumgebung – als Base und als Säure reagieren. Teilchen, die als Protonendonatoren und als Protonenakzeptoren wirken können, werden als Ampholyte bezeichnet; das Verhalten nennt man amphoter.
Protolysen in wasserfreier Umgebung
Protolysen können auch ohne Wasser stattfinden. So können die beiden Gase Ammoniak und Chlorwasserstoff direkt zum Feststoff Ammoniumchlorid reagieren:
Indikatoren
Definition
Indikatoren sind Farbstoffe, deren Farbe davon abhängt, ob sie sich in saurer, basischer oder neutraler Lösung befinden. Universalindikatoren nehmen eine Sonderstellung ein. Bei ihnen handelt es sich nicht um Reinstoffe, sondern um Indikatorgemische. Diese Gemische zeigen keine scharfen Farbumschläge, sondern gleitende Farbübergänge. So kann man auch feststellen, wie stark eine Säure oder Base ist.
Wie erfüllt ein Indikator seine Aufgabe?
Ein Indikator ist ein Teilchen (meist ein Molekül oder Ion), das Ionen aufnehmen oder abgeben kann. Bei der Aufnahme (oder Abgabe) ändert sich die Farbe (siehe unter Chemie: 11. Klasse eine ausführliche (über den Lehrplan der 9. Klasse hinausgehende) Erklärung).
Nimmt man zum Beispiel den Indikator Lackmus, färbt sich die Lösung bei einer Protonenabgabe blau, bei einer Protonenaufnahme rot. Dies kann man nachweisen, indem man zu Lackmus eine alkalische Lösung gibt (Blaufärbung) oder eine saure, bei der die Rotfärbung stattfindet.
Überblick wichtiger Indikatoren
Wenigstens folgende Indikatoren sollte man kennen:
- Lackmus
- Phenolphtalein
- Universalindikator
- Bromthymolblau
- Methylorange
- Methylrot
Die pH-Skala und die pOH-Skala
Der pH-Wert ist ein Maß für die Konzentration an Oxoniumionen in einer Lösung; er umfasst (normalerweise) einen Zahlenbereich von 0 bis 14; eine neutrale Lösung hat dabei den pH-Wert von 7, saure Lösungen weisen einen pH < 7 und basische Lösungen einen pH > 7 auf.
Der pOH-Wert gibt die Konzentration von Hydroxidionen an. Die Skala geht auch hier von 0 bis 14, wobei hier die Werte pOH < basisch und die Werte pOH > 7 sauer sind. Diese Skala ist aber hier noch nicht zu können.
Die Neutralisation
Bei einer Neutralisierung reagieren Oxoniumionen mit Hydroxidionen zu Wasser. Dabei wird Energie freigesetzt. Der n-Punkt einer Neutralisation hat den Namen Säure-Base-Titration. Wenn man eine bekannte Säure zu einer unbekannten Konzentration Lauge tropft, dann lässt sich die Konzentration dieser Lauge berechnen.
Gibt man zum Beispiel zwei Lösungen, die zum Einen mit Chlorwasserstoff versetzt wurde und zum Anderen mit Natriumhydroxid, in gleichem Maße zusammen, reagieren die Oxoniumionen und Hydroxidionen zu Wasser und die Lösung wird (annähernd) neutral.
Redoxreaktionen
Redoxreaktionen sind Reaktionen, bei denen Elektronen von einem Teilchen auf einen Reaktionspartner übergeben werden. Sie besteht dabei aus zwei Reaktionen: Bei der Oxidation wird ein Elektron bzw. mehrere Elektronen abgegeben, während bei der Reduktion diese aufgenommen werden.
Beispiel
Magnesium reagiert mit Sauerstoff zu Magnesia (Magnesiumoxid) und gibt dabei Elektronen ab, die der Sauerstoff aufnimmt, d.h. Magnesium ist ein Oxidationsmittel, Sauerstoff ein Reduktionsmittel.
Oxidationszahl
Um den verschiedenen Teilchen einer chemischen Reaktion Oxidationsstufen (-zahlen) zuordnen zu können, sind einige Regeln notwendig. Diese Zahlen werden über die Atome in der Summenformel geschrieben. Bei der Ermittlung von Oxidationszahlen geht man folgendermaßen vor (wobei man arabische oder römische Zahlen benutzen kann):
- Elemente haben immer die Oxidationszahl null
- Summe der Oxidationszahlen in ungeladenen Molekülen ist null
- Alle Metalle haben in ihren Verbindungen positive Oxidationszahlen
- Wasserstoff hat in Verbindungen immer die Oxidationszahl +I
- Sauerstoff hat in Verbindungen immer die Oxidationszahl -II (Ausnahme Wasserstoffperoxid: Hier hat der Sauerstoff -I)
- Die Oxidationszahl von einfachen Ionen (Atomionen) bzw. die Summe der Oxidationszahlen von Molekülionen entspricht der Ladungszahl dieser Ionen. So hat ein Chloridion -I
Anwendungen von Redoxreaktionen
Elektrolyse
Bei einer Elektrolyse werden durch die Einwirkung von elektrischer Energie Stoffe zersetzt. Auf diese Weise wird z.B. aus Kupferchlorid- (CuCl2) Lösung oder einer Aluminiumoxidschmelze unter Energieverbrauch das entsprechende Metall hergestellt.
Elektrochemische Stromerzeugung in Batterien und Akkus
Bei einer elektrochemischen Stromerzeugung in Batterien und Akkus läuft ebenfalls eine Redoxreaktion ab. Die Stromerzeugung gelingt durch Trennung von Redoxpaaren, wodurch sich eine Spannung aufbaut. Schließt man den Stromkreis über einen Verbraucher, so fließen Elektronen; das System liefert Strom.
Brennstoffzelle
In einer Brennstoffzelle werden – energetisch und ökologisch bedeutend – an getrennten Elektroden Wasserstoff oxidiert und Sauerstoff reduziert, um damit Wasser zu synthetisieren. Mit dieser Redoxreaktion lässt sich Strom erzeugen, indem eine direkte Umwandlung der chemisch-gebundenen Energie in elektrische ermöglicht wird.
Die Elektrodenübergänge erfolgen damit wie folgt (unter der Voraussetzung, dass eine saure Umgebung vorhanden ist):