- Aromatische Kohlenwasserstoffe
- Benzol
- Eigenschaften
- Geschichte
- Delokalisiertes Elektronensystem
- Mesomerie
- Mesomerieenergie
- Elektrophile Substitution: Reaktionsverhalten von Benzol
- Reaktionsmechanismus
- Phenol
- Eigenschaften
- Gründe für den Säurecharakter des Phenols
- Reaktionsmechanismus
- Anilin
- Eigenschaften
- Reaktionsverhalten
- Herstellung von Anilin aus Nitrobenzol
- Farbstoffe
- Phänomen der Farbigkeit
- Farbe als Absorptionsphänomen
- Anregung von Elektronen
- Konjugierte Doppelbindungen
- Substanzklassen mit konjugierten Doppelbindungen
- Zusammenhang zwischen Molekülbau und Farbigkeit
- Azofarbstoffe
- Synthese eines Azofarbstoffs
- Säure-Base-Indikatoren
- Beispiel: Methylorange
- Küpenfärberei – Färben mit Indigo
- Kunststoffe
- Kunststoffe als makromolekulare Stoffe
- Bildung von Makromolekülen
- Radikal-Polymerisation
- Startreaktion
- Kettenstart
- Kettenwachstum
- Kettenabbruch
- Polykondensation
- Beispiel: PET
- Polyaddition
- Polyurethan (PUR)
- Struktur und Eigenschaften der Kunststoffe
- Thermoplaste
- Duroplaste
- Elastomere
- „Kunststoffe nach Maß“
- Moderne Werkstoffe
- Silikone
- Herstellung
- Eigenschaften und Verwendung von Silikonen
- Carbonfasern
- Eigenschaften und Verwendung von Carbonfasern
- Kunststoffabfall
- Verbrennung
- Verwertung
- Lipide und Tenside
- Fette
- Zusammensetzung und Aufbau der Fette
- Fettsynthese
- Eigenschaften
- Fetthärtung
- Verwendung
- Tenside
- Seifen
- Eigenschaften
- Nachteile
- Synthetische Waschmittel: Anionische Tenside
- Kohlenhydrate und Stereochemie
- Die Spiegelbildisomerie
- Die Fischer-Projektion
- Unterscheidung spiegelbildisomerer Substanzen
- Beispiel
- Racemat
- Trennung eines Racemats
- Verbindungen mit mehreren Asymmetriezentren
- Kohlenhydrate
- Definition
- Glucose
- Die Ringstruktur der Glucose
- Die Mutarotation der Glucose
- Fructose
- Furanoseform
- Umlagerung in die Glucose
- Maltose
- Cellobiose
- Saccharose
- Stärke
- Amylose
- Amylopektin
- Cellulose
- Aminosäuren und Proteine
- Aminosäuren
- Chiralität
- Eigenschaften
- Elektrophorese
- Der isoelektrische Punkt (IEP)
- Trennungsverfahren
- Beispiel
- Nachweisreaktionen von Aminosäuren
- Biuret-Reaktion
- Ninhydrin-Reaktion
- Xanthoprotein-Reaktion
- Proteine
- Peptidbindung
- Strukturebenen von Proteinen
- Primärstruktur
- Sekundärstruktur
- Tertiärstruktur
- Quartärstruktur
- Biologische Bedeutung
- Schutz- und Abwehrfunktion
- Motorische Funktion
- Steuerfunktion
- Reaktionsgeschwindigkeit und Enzymkatalyse
- Reaktionsgeschwindigkeit
- Definition
- Versuch zur Ermittlung der Reaktionsgeschwindigkeit
- Durchschnittsgeschwindigkeit
- Momentangeschwindigkeit
- Beschreibung der Reaktionsgeschwindigkeit
- Stoßmodell
- Beispiel: Bildung von Wasserstoffiodid
- Anhang: Aminosäuren in Proteinen
- Allgemeines
- Gruppierung der Aminosäuren nach ihrem Aufbau
- Aliphatische Aminosäuren ohne weitere funktionelle Gruppen
- Aminosäuren mit Hydroxylgruppen
- Saure Aminosäuren und deren Amide
- Basische Aminosäuren
- Cyclische Aminosäuren
- Aromatische bzw. heteroaromatische Aminosäuren
- Die essentiellen Aminosäuren
- Literatur und Quellen
- Literatur
- Quellen
Aromatische Kohlenwasserstoffe
Benzol
Eigenschaften
Benzol ist eine wasserklare, leicht brennbare und stark lichtbrechende Flüssigkeit. Seine Dichte beträgt $\rho = 0,88 \mathrm{\frac{g}{cm^3}}$. Es hat eine Schmelztemperatur $\vartheta_m$ von 5 °C und eine Siedetemperatur $\vartheta_b$ von 80 °C. Es ist ein gutes unpolares Lösungsmittel, das unter stark rußender, leuchtender Flamme verbrennt.
Geschichte
1834 fand Eilhard Mitscherlich heraus, dass die Masse von Benzol, das von ihm als Benzin bezeichnet wurde, 78 u beträgt. Daraus wurde geschlussfolgert, dass das Molekül die Summenformel C6H6 besitzt. 1865 entwickelte August Kekulé einen Vorschlag über die Struktur des Benzols (vgl. Abbildung rechts).
Dagegen sprach jedoch, dass zum einen die elektrophile Addition nicht möglich ist und dass zum anderen es keine zwei 1,2-Dichlorisomere gibt. Daraufhin entwickelte Kekulé die Oszillationstheorie. Demnach „klappen“ die Doppelbindungen an die Stellen, an denen sich die Einfachbindungen befinden:
Delokalisiertes Elektronensystem
Die sechs ungepaarten Elektronen im Benzolmolekül (siehe rechts) können sich über den planaren Sechsring gleichmäßig verteilen. Keines dieser Elektronen ist somit fest an ein Kohlenstoffatom gebunden; sie bilden ein delokalisiertes Elektronensystem.
Mesomerie
Die delokalisierten Bindungsverhältnisse können durch Valenzstrichformeln nicht dargestellt werden. Angenähert kann der Bindungszustand durch zwei Valenzstrichformeln wiedergegeben werden. Der wahre Bindungszustand liegt dabei zwischen den Grenzstrukturformeln.
Man spricht von Mesomerie, wenn die in einem Molekül vorliegenden Bindungsverhältnisse nicht durch eine Valenzstrichformel sondern nur durch mehrere Grenzstrukturformeln dargestellt werden können.
Mesomerieenergie
Moleküle mit einem delokalisierten Elektronensystem sind im Vergleich zu Molekülen mit lokalisierten Elektronen stabiler, da sie energieärmer und dadurch reaktionsträger sind. Benzol ist um $151\,\mathrm{\frac{kJ}{mol}}$ energieärmer als das hypothetische Cyclohexa-1,3,5-trien. Diesen Betrag bezeichnet man als Mesomerieenergie.
Elektrophile Substitution: Reaktionsverhalten von Benzol
Als Beispiel für die elektrophile Substitution soll hier die Reaktion von Benzol mit Brom erklärt werden:
Reaktionsmechanismus
Zunächst wird durch den Katalysator das Brommolekül polarisiert und letztlich heterolytisch gespalten. Dadurch kann sich das Bromidion aufgrund seiner negativen Ladung an den Katalysator anlagern, das Bromkation lagert sich dagegen an das Benzol, wodurch sich eine positive Ladung bildet: Dieser σ-Komplex bzw. dieses Carbokation ist mesomeriestabilisiert.
Als nächstes wird das Wasserstoff, das sich am gleichen Kohlenstoffatom wie das Bromatom befindet, als Proton abgespalten. Es reagiert mit dem „ehemaligen“ Bromidion des Moleküls zu Bromwasserstoff. Der Katalysator geht daher unverändert aus der Reaktion hervor.
Phenol
Eigenschaften
Phenol ist ein kristalliner Feststoff mit einer Schmelztemperatur $\vartheta_m$ von 43 °C sowie einer Siedetemperatur $\vartheta_b$ von 182 °C, da sich durch die polare Hydroxygruppe Wasserstoffbindungen ausbilden können, die nur mit einer höheren Energiezufuhr gelöst werden können. Eine Phenollösung ist schwach sauer.
Gründe für den Säurecharakter des Phenols
Das Phenol ist im Vergleich zu einem Alkanol in der Lage, ein Proton leichter abzugeben, da sich durch die Ausbildung mesomerer Grenzstrukturen eine höhere Polarität in der OH-Gruppe ausbildet:
Außerdem wird das Phenolation durch die Delokalisierung seiner negativen Ladung über den aromatischen Ring stabilisiert:
Reaktionsmechanismus
Das Phenyl reagiert nach dem Prinzip der elektrophilen Substitution (s. oben). Dies geschieht am Phenylrest. Bei der Grenzstruktur lagert sich das Elektrophil (z.B. Brom) bevorzugt am unteren Ende, der para-Position an.
An der meta-Position ist keine Substitution beobachtbar, da hier (in den Grenzstrukturen) keine negative Formalladung auftritt. Die Anlagerung an die para-Position tritt häufiger auf als die an der ortho-Position, da an dieser Stelle der größtmögliche räumliche Abstand zur OH-Gruppe besteht.
Anilin
Eigenschaften
Anilin ist eine ölige, farblose Flüssigkeit mit einer Schmelztemperatur $\vartheta_m$ von –6 °C und einer Siedetemperatur $\vartheta_b$ von 184 °C. Es ist für Organismen sehr giftig, da es im Hämoglobin zur Veränderung von Fe2+ zu Fe3+ führt, was eine Sauerstoffbindung behindert.
Reaktionsverhalten
Das Reaktionsverhalten ist wie beim Benzol und Phenol die elektrophile Substitution. Vergleicht man jedoch die Basizität von Anilin und Ethylamin (C2H5NH2) miteinander, kann man beobachten, dass Anilin die schwächere Base ist.
Dies liegt daran, dass aufgrund der Delokalisation (siehe unten) am Stickstoff das Elektronenpaar schlechter zur Verfügung gestellt werden kann, welches benötigt wird, um ein Proton aufnehmen zu können. Außerdem ist das Aniliniumion nur über den Phenylrest mit zwei Grenzstrukturen mesomeriestabilisiert.
Herstellung von Anilin aus Nitrobenzol
Anilin stellt man aus Nitrobenzol her. Dieses wird in eine saure Lösung gegeben und dadurch reduziert. Bei der Oxidation reagiert Eisen mit Wasser zu Magnetit und Oxoniumionen.
\text{Ox.: } & \mathrm{Fe \:+\: 12\,H_2O} & \longrightarrow\;\; & \mathrm{ Fe_3O_4 \:+\: 8\,e^- \:+\: 8\,H_3O^+} & \mid \cdot \,3\\
\text{Redox.: } & \mathrm{4\,C_6H_5NO_2 \:+\: 3\,Fe + 4\,H_2O} & \longrightarrow\;\; & \mathrm{4\,C_6H_5NH_2 \:+\: 3\,Fe_3O_4} \end{align*}$$
Farbstoffe
Phänomen der Farbigkeit
Farbe als Absorptionsphänomen
Das Licht ist eine elektromagnetische Strahlung. Der Mensch kann dabei ein Spektrum sehen, dessen Wellenlänge $\lambda$ ungefähr zwischen 400 und 700 nm liegt (1 nm = 10-9 m). Alle Farben dieses Bereichs ergeben zusammen die „Farbe“ weiß. Der Farbeindruck wird dabei durch den nicht absorbierten Teil erzeugt.
Die Energie, die die Farbe besitzt, hängt von der Wellenlänge der Farbe ab:
Dabei ist $h$ das sog. Plancksche Wirkungsquantum. Es hat einen Wert von
In der Formel ist $c$ die Lichtgeschwindigkeit. Sie hat einen Wert von
Anregung von Elektronen
Der Farbeindruck entsteht durch die Anregung von Elektronen eines Moleküls. Dieser entspricht der Energie der absorbierten Strahlung. Dadurch werden die Elektronen vom Grundzustand in einen instabileren, angeregten Zustand „gehoben“.
Aus diesem angeregten Zustand fällt das Elektron innerhalb kürzester Zeit (ca. 10-8 s) wieder in den Grundzustand zurück, indem es die Energie, die es zuvor aufgenommen hat, meist in Form von Wärme oder Licht abgibt. Je mehr Energie zur Anregung notwendig ist, desto kurzwelliger ist das abgegebene Licht.
Konjugierte Doppelbindungen
Von konjugierten Doppelbindungen spricht man, wenn in einem Molekül auf eine Doppelbindung eine Einfachbindung folgt. Dadurch kann ein delokalisiertes Elektronensystem entstehen.
Diese delokalisierten Elektronen lassen sich leichter anregen, da sie keinem einzelnen Atom zugeordnet sind. Je größer das System konjugierter Doppelbindungen ist, desto weiter können sich die Elektronen im Molekül bewegen, desto weniger Energie ist zur Anregung notwendig und desto langerwelliger ist das absorbierte Licht.
Ab etwa acht konjugierten Doppelbindungen findet die Absorption im sichtbaren Bereich statt, wodurch die Substanz farbig wird.
Substanzklassen mit konjugierten Doppelbindungen
Biologisch wichtige Farbstoffe mit konjugierten Doppelbindungen sind zum Beispiel Hämoglobin, Chlorophyll und Charotin. Natürliche Färbemittel wie Indigo oder synthetische Farbstoffe (z.B. Azofarbstoffe) enthalten ebenfalls welche.
Zusammenhang zwischen Molekülbau und Farbigkeit
1876 entwickelte Otto Nikolaus Witt die chemische Farbstofftheorie. Sie beruht auf einer Einteilung von bis zu drei Strukturteilen in den Farbstoffmolekülen:
- Chromophore Gruppen: Sie bilden den Farbträger. Sie sind für das Zustandekommen der Farbe nötig. Es sind immer Gruppen mit Mehrfachbindungen und konjugierten Systemen (z.B. CC-, CO-, NO-, NN-Bindungen)
- Auxochrome Gruppen: Sie sorgen in Kombination mit den chromophoren Gruppen für eine Farbverstärkung, da sie Elektronendonatoren sind und damit eine Farbverschiebung in den langwelligeren Bereich bewirken. Man spricht auch vom bathochromen Effekt. Dazu zählen z.B. NH2- und OH-Gruppen.
- Antiauxochrome Gruppen: Sie sind Elektronenakzeptoren wie NO2 oder R-CO und verstärken so den Farbeindruck.
Azofarbstoffe
Die Ausgangssubstanz aller Azofarbstoffe ist Anilin. Alle enthalten die zentrale funktionelle Azogruppe (-N=N-), an der zwei aromatische Reste hängen. Der einfachste Azofarbstoff ist Azobenzol, der Strahlung aus dem blaugrünen Bereich absorbiert und deshalb orangerot erscheint.
Synthese eines Azofarbstoffs
Die Herstellung soll an dieser Stelle am Beispiel von Dimethylgelb (p-Dimethylaminobenzol) erklärt werden.
Als erstes muss eine Diazotierung durchgeführt werden. Dabei wird das Anilin, die Diazokomponente, mit salpetriger Säure zur Reaktion gebracht. Dabei wird unter Wasserabspaltung N-Nitrosoanilin gebildet, was unter Hinzugabe von Salzsäure zu Benzoldiazoniumchlorid, das Diazoniumsalz, und Wasser reagiert:
Danach führt man eine Kupplungsreaktion, die eine elektrophile Substitution ist, mit Dimethylanilin, der Kupplungskomponente, durch. Dabei bildet sich der Azofarbstoff und Salzsäure:
Säure-Base-Indikatoren
Säure-Base-Indikatoren sind meist organische Farbstoffe, die je nach pH-Wert mit unterschiedlicher Struktur vorliegen. Diese beeinflusst ihr Absorptionsverhalten und damit ihre Farbe.
Beispiel: Methylorange
Methylorange ist ein Azofarbstoff, der bei einem pH-Wert von unter 3 rot und bei über 4,4 orange ist. Im ersten Fall liegt vor allem die protonierte Form des Methylorangemoleküls vor, in weniger sauren und basischen Lösungen die deprotonierte Form.
„Bei der Protonierung oder Deprotonierung [...] des Methyloranges bleibt die Zahl der konjugierten Doppelbindungen sowie der Elektronendonatoren und -akzeptoren gleich. Die Änderung des Absorptionsverhaltens hat daher eine andere Ursache. [...]
Bei der deprotonierten Form des Methylorangemoleküls kommt es bei einer der Grenzstrukturformeln zum Auftreten neuer formaler Ladungen. [...] Der wahre Bindungszustand entspricht [deshalb] eher der energetisch günstigeren Grenzstrukturformel ohne zusätzliche formale Ladungen. [Die] Delokalisation der deprotonierten Form [ist] nicht so ausgeprägt.
Bei der protonierten Form [...] sind beide Grenzstrukturformeln ähnlicher, d.h. die Delokalisierung ist ausgeprägter und die Elektronen können leichter angeregt werden. Das Absorptionsmaximum ist somit in den langwelligeren Bereich verschoben.“[2]Galvani Chemie Schülerbuch 11 S. 40
Küpenfärberei – Färben mit Indigo
Indigo ist ein natürlicher Farbstoff, der wasserunlöslich und bei Raumtemperatur fest ist. Er wird nicht direkt zum Färben genutzt, sondern das Resultat einer Redoxreaktion, der gelb-grüne Leukoindigo:
Das Gewebe färbt sich anschließend durch die Oxidation von Leukoindigo zu Indigo durch den Luftsauerstoff blau, da der Stoff Licht des gelben Spektrums absorbiert.
Kunststoffe
Kunststoffe als makromolekulare Stoffe
Kunststoffe sind organische Makromoleküle, die durch kovalente Verknüpfung von kleinen, sich wiederholenden Molekülbausteinen, den Monomeren entstehen. Sie werden deshalb als Polymere bezeichnet. Um die Strukturformel der Makromoleküle anzudeuten, schreibt man die Repetiereinheit, d.h. die sich wiederholende Struktureinheit, in eckige Klammern geschrieben.
Die ersten Kunststoffe wurden auf der Basis von Naturstoffen hergestellt (z.B. Gummi: Vernetzung von Kautschuk-Makromolekülen mit Schwefel). Die späteren Kunststoffe sind aus Bausteinen hergestellt, die aus Erdöl gewonnen werden.
Bildung von Makromolekülen
Radikal-Polymerisation
Die radikalische Polymerisation ist eine Kettenreaktion, bei der ungesättigte Monomere unter Radikalbindung zu Polymeren reagieren. Dabei laufen die vier Schritte Startreaktion, Kettenreaktion, Kettenwachstum und Kettenabbruch ab.[1]ebd., S. 54
Dies soll an der Kettenpolymerisation des Polyethens erklärt werden.
Startreaktion
Um die Kettenreaktion zu starten, benötigt man Radikale, die aus Radikalbildnern entstehen. Diese enthalten eine homolytische Bindung, die leicht zerfällt. Dibenzoylperoxid kann zum Beispiel für diesen Vorgang verwendet werden.
Kettenstart
Diese Startradikale brechen die Doppelbindungen auf, wodurch ein Radikal des Monomers entsteht.
Kettenwachstum
Die gebildeten Radikale können nun bei anderen Molekülen die Doppelbindungen aufbrechen, wodurch wieder Radikale entstehen. So bilden sich immer länger werdende Molekülketten
Kettenabbruch
Theoretisch könnte die Kette weiterwachsen bis alle Monomere aufgebraucht sind. In Wirklichkeit kommt es aber zu Kettenabbruchreaktionen, wenn zwei aktive Zentren miteinander reagieren.
Man kann den Abbruch auch durch den Einsatz von Inhibitoren beeinflussen. Sie sind schwache Radikalmoleküle, die zwar keine Startreaktion mit Monomeren auslösen können, aber zur Kombination mit aktiven Zentren befähigt sind.
Polykondensation
Die Polykondensation ist eine Kettenreaktion, bei der zur Verknüpfung der Monomere kleinere Moleküle, z.B. Wasser, abgespalten werden. Dabei verbinden sich Monomere mit mindestens zwei funktionellen Gruppen.
Beispiel: PET
Polyethylenterephthalat – kurz PET – ist ein Polyester, welches aus den Molekülen 1,4-Benzoldicarbonsäure (Terephthalsäure) und Ethan-1,2-diol gebildet wird, es entsteht also ein Ester. Dabei werden Wassermoleküle abgespalten:
Da zur Ausbildung eines Polymers zwei funktionelle Gruppen pro Monomer vorhanden sein müssen und bei Polyestern Moleküle mit Carboxy- und Hydroxygruppen vorliegen, reagieren meistens Dicarbonsäuren mit Diolen. Es können jedoch auch nicht verschiedene Monomere reagieren, wenn sie beide Arten der funktionellen Gruppen haben.
Polyaddition
Die Polyaddition ist eine Kettenreaktion, bei der die Bildung der Makromoleküle erfolgt, ohne dass Molekülteile aus den reagierenden Gruppen abgespalten werden. Die Neuverknüpfung von Verbindungen erfolgt in der gleichzeitigen Wanderung eines Wasserstoffatoms.
Polyurethan (PUR)
Polyurethane sind aufgrund ihrer Vielseitigkeit in vielen Bereichen im Einsatz, z.B. im Fahrzeugbau. Die
Monomere sind mehrwertige Alkohole und Diisocyanate. Isocyanate sind Moleküle mit der funktionellen
Gruppe .
Das O-Atom des Alkohols reagiert dabei mit dem Kohlenstoffatom des Isocyanats:
Struktur und Eigenschaften der Kunststoffe
Thermoplaste
Thermoplaste erweichen beim Erwärmen (bei einem breiten Schmelzbereich) und sind in diesem Zustand verformbar. Kühlen sie ab, erhärten sie in der neuen Form. Ein Beispiel für Thermoplaste sind alle linearen Makromoleküle.
Duroplaste
Duroplaste sind langmaschig vernetzte Molekülketten, die beim Erwärmen nicht verformbar sind. Starkes Erhitzen führt zu einer Zersetzung. Sie haben eine Vernetzung von Monomeren mit mindestens drei funktionellen Gruppen. Bakelit ist ein Vertreter der Duroplaste.
Elastomere
Elastomere zeichnen sich durch weitmaschig vernetzte Molekülketten aus, die bei Zugbeanspruchung ein gummiartiges Verhalten zeigen. Man kann sie nicht zum Schmelzen bringen, da sie sich bei hohen Temperaturen zersetzen.
„Kunststoffe nach Maß“
Durch verschiedene Maßnahmen kann man Kunststoffe der Verwendungsart anpassen. Dies kann u.a. mit Weichmachern geschehen oder durch die Änderung der Produktionsbedingungen. So kann man Polyethen auf zwei Arten herstellen.
Setzt man ein Hochdruckverfahren ein, wird weiches Polyethen erzeugt, da sich kürzere Ketten bilden. Wegen seiner geringeren Dichte spricht man von PE-Low-Density (PELD). Im Niederdruckverfahren wird in Verbindung mit Katalysatoren hartes PE-High-Density (PEHD) hergestellt.
Moderne Werkstoffe
Silikone
Herstellung
Silikone werden hergestellt, indem man zwei Chlormethanmoleküle mit Silicium reagieren lässt. Dabei entsteht Dichlorolimethylsilan, das bei Wasserzugabe unter Abspaltung von Salzsäure Dimethylsilandiol bildet. Dieses kann mit einem anderen Monomer unter Wasserabspaltung ein Polymer bilden:
Eigenschaften und Verwendung von Silikonen
Silikone weisen eine hohe Temperaturbeständigkeit auf und sind ebenso beständig gegenüber Wettereinflüssen und chemischen Stoffen. Zudem bieten sie eine gute Isolation.
Sie werden als (Ver)Dichtungsmaterial und Isoliermaterial verwendet. Zum Einsatz kommen sie zudem in der Medizin (z.B. als Herzklappen) und als Imprägniermittel.
Carbonfasern
Carbonfasern sind carbonfaserverstärkte Kunststoffe (CFK). Sie entstehen durch Erhitzen organischer Fasern.
Eigenschaften und Verwendung von Carbonfasern
Sie sind härter als Stahl und leichter Aluminium und haben eine geringe Dichte, aber zudem eine hohe Temperaturbeständigkeit sowie gute Dämpfungseigenschaften.
Deshalb werden sie beim Fahrzeugbau (z.B. Leitwerke bei Flugzeugen) und bei den Rotoren von Windrädern verbaut.
Kunststoffabfall
Kunststoff ist im Allgemeinen sehr langlebig. Zudem kann es nicht zersetzt werden, es verrottet also nicht. Zudem gibt es Probleme bei der Entsorgung, insbesondere der Deponierung, weshalb man nach Alternativen sucht.
Verbrennung
Kunststoffe besitzen einen großen Energiegehalt. Sie können mit Sauerstoff reagieren und geben dabei Wärme ab, was in Müllverbrennungsanlagen zur Energiegewinnung genutzt wird. Bei vollständiger Verbrennung werden Kohlenstoffdioxid und Wasser frei, bei einer unvollständigen auch giftiges Kohlenmonooxid, kurzkettige Kohlenwasserstoffe, Außerdem führt dies zu einer hohen Feinstaubbelastung.
Werden zudem PVC-haltige Kunststoffe verbrannt, können die Kohlenstoffatome zur Bildung von giftigen Dioxinen, die erbgutschädigende und krebserregende Zellgifte sind, und anderen Chlorverbindungen führen.
Verwertung
Da die Verbrennung sowohl ökologisch als auch ökonomisch bedenklich ist, da Rohstoffe verloren gehen und die Umwelt belastet wird, wird das Recyclingverfahren zunehmend wichtiger. Dabei sind jedoch Nutzen und (Energie)Kosten abzuwägen.
So können Polyester und -amide durch Hydrolyse bei circa 200°C in Monomere zersetzt werden. Die Pyrolyse (Hitzespaltung) bei 700-800°C zerlegt sie weiter in niedermolekulare Bruchstücke. Es findet keine Verbrennung aufgrund des fehlenden Sauerstoffs statt.
Die Zersetzungsprodukte sind ein Gemisch aus Kohlenwasserstoffverbindungen; dieses Rohgas wird nach der Kühlung und Reinigung in verschiedene Fraktionen getrennt. Pyrolyseöl (Alkane, Alkene, Aromaten) ist dann Ausgangsstoff für die Synthese neuer Kunststoffe.
Lipide und Tenside
Fette
Zusammensetzung und Aufbau der Fette
Fette sind Ester aus Glycerin und Fettsäuren. Diese Säuren sind langkettige Carbonsäuren. In Fetten kommen folgende Fettsäuren häufig vor:
Fettsynthese
Die Fettsynthese ist eine Esterreaktion zwischen den Hydroxygruppen des Glycerins und der Carboxylgruppe der Säuren. Dabei werden drei Wassermoleküle abgespalten, das weitere Produkt bezeichnet man als Triacylglycerin:
Man spricht von einem einfachen Triacylglycerin, wenn die drei Reste gleich sind, also zum Beispiel nur Palmitinsäure sind; von einem gemischten Triacylglycerin ist die Rede, wenn mindestens einer der Reste verschieden ist. Fette sind dabei immer Gemische dieser zwei „Arten“.
Eigenschaften
Öle enthalten mehr ungesättigte Fettsäuren als feste Fette (niedrigerer Schmelzbereich) aufgrund der geringeren zwischenmolekularen Kräfte und vor allem wegen der Struktur (Z-Konfiguration). Der Schmelzpunkt wird durch die Masse und durch die Zahl der Doppelbindungen beeinflusst.
| Fettsäure | Schmelzpunkt |
| Palmitinsäure | 63 °C |
| Stearinsäure | 70 °C |
| Ölsäure | 13 °C |
| Linolsäure | –5 °C |
| Linolensäure | –11 °C |
Die Z-Konfiguration bedingt dabei einen Knick in der Molekülkette, wodurch eine regelmäßige Anordnung in einem Feststoffgitter erschwert wird. Deshalb sind ungesättigte Fettsäuren bei Raumtemperatur flüssig (vgl. Tab. 1).
Mit der Iodzahl kann man angeben, ob in einem Fett viel oder wenig Fettsäuren vorhanden sind. Sie gibt an, wie viel Gramm Iod von 100 Gramm des untersuchten Fettes gebunden werden (durch elektrophile Addition). So hat z.B. Kokosfett eine Iodzahl von 7-10, Milchfett: 33-43 und Sonnenblumenöl 125-136.
Außerdem besitzen Fette folgende Eigenschaften:
- Farblos bis gelb
- Geschmack- und geruchlos
- Geringere Dichte als Wasser
- Gut löslich in hydrophoben Lösungsmitteln (aufgrund der langen unpolaren Alkylresten)
- Bei Raumtemperatur schwer flüchtig (Fettfleckprobe)
Bei längerem Lagern unter Luft- und Lichteinwirkung tritt die unangenehme Folge auf, dass das Fett ranzig wird. Dabei laufen zwei Prozesse nebeneinander ab:
- Hydrolytische Spaltung des Fettmoleküls: Es treten freie Fettsäuren auf. Ein Maß für die Konzentration freier Fettsäuren in einem Fett ist die Säurezahl; sie gibt an, wie viel Milligramm Kalilauge zur Neutralisation von 1g Fett benötigt werden. Sie ist damit einen Hinweis auf die Frische des Fettes.
- Ungesättigte Fettsäuren werden leicht oxidiert an der Doppelbindung und nachfolgend aufgespalten. Dabei treten Bruchstücke mit unangenehmen Geruch auf.
Fetthärtung
Aus Ölen werden feste Fette:
Durch Hydrieren werden aus Pflanzenölen feste Fette gewonnen, die für die menschliche Ernährung (z.B. Margarinenherstellung) und für technische Zwecke (u.a. Seifenherstellung) herangezogen werden.
Bei der Herstellung von Fetten zur Margarinenproduktion findet eine partielle Hydrierung statt, um einen bestimmten Prozentsatz an essentiellen Fettsäuren zu erhalten.
Verwendung
Fette sind wichtig als Nahrungsmittel. So benötigt man wegen fettlöslicher Vitamine circa 60-70 Gramm Fett pro Tag. Außerdem wird damit Energie gespeichert. So kann eine Person mit einer Masse von 70 Kilogramm circa 11 Kilogramm Fett speichern, was einem Energiewert von ungefähr 400.000 kJ entspricht.
Fette bekommen aufgrund der größeren Nachfrage nach Biodiesel zusätzlich eine größer Bedeutung.
Tenside
Als Tenside (lat. tensio Spannung) werden Stoffe genannt, die die Oberflächenspannung von Wasser herabsetzen. Zu ihnen zählen Seifen und synthetische Waschmittel; letztere bezeichnet man auch als Detergentien.
Seifen
Seifen sind Natrium- und Kaliumsalze höherer Fettsäuren. Die Herstellung bezeichnet man als Fettverseifung. Verwendet man Natriumhydroxid bekommt man Kernseife, bei Kaliumhydroxid die Schmierseife.
Die Fettsäuren werden mit einem modernen Hochdruckverfahren hergestellt: Fett und überhitzter Wasserdampf reagieren bei Temperaturen von 100-250°C und einem Druck von 60 bar zu den Fettsäuren und Glycerin. Nach Abtrennung des Glycerins liegen die Ionen vor.
Eigenschaften
Die Eigenschaften der Seife werden durch den Bau des amphiphilen Seifenanions (mit dem hydrophoben Alkylrest und der hydrophilen Carboxylatgruppe) bestimmt:
- Herabsetzung der Oberflächenspannung und damit besseres Benetzungsvermögen (s. unten)
- Mizellenbildung (s. unten)
- Ablösen einer Fettverschmutzung von einer Faser
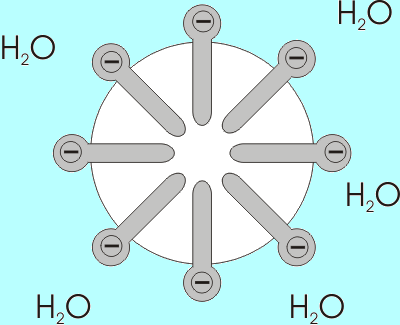
Die Umnetzung mit Seifenanionen führt dazu, dass die wasserunlöslichen Schmutzpartikel als Kerne einer Mizelle in Lösung gebracht werden. Die nach außen gerichteten negativen Ladungen verhindern durch elektrostatische Abstoßung, dass sich in Lösung gebrachte Schmutzpartikel wieder zusammenlagern oder erneut auf die Textilfasern aufziehen.
Nachteile
Durch die alkalische Reaktion der Seifenanionen mit Wasser (pH ≈ 8,5-9) ergeben sich Nachteile bei ihrer Verwendung:
- Unangenehm für die Haut durch den Angriff des Säureschutzfilms
- Schäden an alkaliempfindlichem Gewebe (z.B. Polyamide, -ester, Seide, Wolle)
- Ausfällen von Fettsäuren in sauren Milien
- Bildung unlöslicher Kalkseifen mit Magnesium- und Calciumionen
- Keine bzw. schlechtere Waschwirkung bei hartem Wasser
- Können sich im Gewebe anlagern (Folge: Gewebe kann brüchig werden)
- Kann zu allergischen Hautreaktionen führen
Synthetische Waschmittel: Anionische Tenside
Beispiele für anionische Tenside ist die Gruppe des Alkylbenzolsulfonats (ABS), die sehr schwache Basen sind. Sie besitzen zwischen acht und sechzehn Methylgruppen.
Die Vorteile dieses Tensids sind, dass der pH-Wert neutral bleibt, sich keine schwerlöslichen Kalkseifen bilden und es eine Waschaktivität auch im sauren Bereich gibt.
Kohlenhydrate und Stereochemie
Die Spiegelbildisomerie
Spiegelbildisomerie, oder auch Enantiomerie, tritt auf, wenn sich Bild und Spiegelbild eines Gegenstands nicht zur Deckung bringen lassen. Voraussetzung für das Auftreten der Enantiomerie ist Chiralität, d.h. ein Kohlenstoffatom ist asymmetrisch. Dies ist der Fall, wenn es mit vier verschiedenen Substituenten verbunden ist.
Ein weiteres Beispiel eines spiegelbildisomeren Moleküls ist Glycerinaldehyd (2,3-Dihydroxypropanal). Es besitzt an seinem zweiten Kohlenstoffatom ein Asymmetriezentrum. Dadurch kann es in zwei Formen vorliegen:
Die Fischer-Projektion
Neben dieser waagrechten Projektion gibt es die sogenannte Fischer-Projektion. Bei dieser gibt es folgende Regeln zu beachten:
- Vertikale Anordnung der Kohlenstoffkette
- Kohlenstoffatom mit der größten positiven Ordnungszahl steht oben
- Die horizontalen Bindungen am Asymmetriezentrum ragen aus der Papierebene heraus, die vertikalen zeigen in die Papierebene
Nach diesen Regeln wird das Glycerinaldehyd wie folgt dargestellt, wobei man zwischen dem D-Glycerinaldeyhd und dem L-Glycerinaldeyhd unterscheiden kann, je nachdem, ob die funktionelle Gruppe am Asymmetriezentrum auf der rechten bzw. linken Seite steht:
Unterscheidung spiegelbildisomerer Substanzen
Enantiomere besitzen die gleichen physikalischen Konstanten wie Siede- und Schmelztemperatur, Dichte und zeigen die gleiche chemische Reaktionsfähigkeit. Sie unterscheiden sich nur dadurch, dass sie die Schwingungsebene von linear polarisiertem Licht zwar um den gleichen Betrag jedoch in entgegengesetzte Richtung drehen. Man sagt, dass sie eine optische Aktivität zeigen.
Der Drehwinkel $\alpha$ ist dabei kongruent zu dem Produkt aus der Länge der durchstrahlten Küvette und der Dichte der Lösung.
\begin{array}{rll} [\alpha]_D^{20} & : & \small{\text{spezifischer Drehwinkel einer Substanz, gemessen bei 20\,}^\circ\text{C und}}\\
& & \small{\text{mit gelbem Licht (D-Linie) einer Natrium-Dampflampe (}\lambda\text{ = 589 nm)}} \\
d & : & \small{\text{L\"ange der durchstrahlten K\"uvette (in dm)}} \\ \rho^* & : & \small{\text{Dichte (Verh\"altnis zwischen der Substanz (g) und der L\"osung (cm}^3\text{))}} \end{array} $$
Sie werden als rechtsdrehend (+), wenn sie die Schwinungsebene im Uhrzeigersinn drehen, oder als linksdrehend (-), wenn sie die Schwingungsebene gegen den Uhrzeigersinn drehen, bezeichnet. Dabei blickt man in Richtung der Lichtquelle. Die Position der asymmetrischen Gruppe ist unabhängig von der Drehung; sie ist damit nur experimentell bestimmbar.
Beispiel
D-Glycerinaldehyd zeigt eine optische Aktivität von $[\alpha]_D^{20} = +\,14\,^\circ$, weshalb sie als D-(+)-Glycerinaldehyd bezeichnet wird. L-Glycerinaldehyd heißt entsprechend L-(-)-Glycerinaldehyd, da hier eine optische Aktivität von $[\alpha]_D^{20} = -\,14\,^\circ$ vorliegt.
Racemat
Ein Gemisch, das von jedem Enantiomeren gleich viele Moleküle aufweist, wird als Racemat bezeichnet. Es ist optisch inaktiv, weil die Drehung, die durch ein Molekül des einen Enantiomers hervorgerufen wird, durch eine gleich große, entgegengesetzte Drehung eines anderen wieder aufgehoben wird. Man spricht von einer intermolekularen Kompensation.
Ein Racemat entsteht immer dann, wenn eine optisch aktive Substanz aus einer optisch inaktiven Substanz hergestellt wird. Dies ist zum Beispiel bei der Oxidation von Glycerin der Fall:
Trennung eines Racemats
Möchte man ein Racemat trennen, bildet man zunächst aus dem Racemat und einem D-Alkohol Ester. Diese sind nicht mehr enantiomer sondern diastereomer (d.h. Stereoisomere, die nicht Spiegelbildisomere sind); dadurch sind sie durch Destillation voneinander trennbar. Den Ester kann man spalten und durch erneute Destillation ebenfalls trennen.
Verbindungen mit mehreren Asymmetriezentren
Besitzt ein Molekül mehr als ein Asymmetriezentrum nimmt die Zahl der Stereoisomere im Verhältnis 2n zu. Dabei ist n die Anzahl der Zentren. Das unterste Chiralitätszentrum bestimmt dabei den Namen des Moleküls.
Nimmt man zum Beispiel die organische Verbindung 2,3-Dichlorpetan, liegt ein Molekül mit zwei Asymmetriezentren am zweiten und dritten Kohlenstoffatom vor. Es besitzt damit vier Stereoisomere, die wie folgt aussehen:
Ein weiterer besonderer Fall tritt bei der Weinsäure (2,3-Dihydroxybutandisäure) auf:
Die ersten zwei Moleküle bezeichnet man als meso-Weinsäure, da sie identische Formen sind; sie sind durch eine 180°-Drehung ineinander überführbar, weil sie eine Spiegelebene besitzt; sie sind optisch inaktiv. Da dies innerhalb des Moleküls geschieht, spricht man von einer intramolekularen Kompensation.
Kohlenhydrate
Definition
Im 19. Jahrhundert führten die ersten Analysen der Kohlenhydrate zu der Summenformel Cn(H2O)m. Daher kommt der Begriff Kohlen(stoff)hydrat.
Heute bezeichnet man damit eine weit verbreitete Gruppe von Naturstoffen, die bei allen Organismen als Bau-, Reserve- und Betriebsstoffe auftreten. Sie enthalten die Elemente Kohlen-, Wasser- und Sauerstoff (einige auch Stickstoff und Schwefel, z.B. Chitin). Als Endung ist häufig „-ose“ anzutreffen.
Man unterscheidet zwischen
- Monosacchariden, Einfachzuckern, die die Monomere darstellen,
- Disacchariden, Zweifachzuckern, die unter Wasserabspaltung aus zwei Monomeren verknüpft werden,
- Polysacchariden, Vielfachzuckern, die aus einer Vielzahl von Monomeren bestehen.
Glucose
Glucose, auch Traubenzucker genannt, ist eine Aldohexose. Sie löst sich in Wasser, jedoch nicht in Benzin, was auf hydrophile Gruppen hinweist. Zudem bildet sie mit Kupfersulfat (CuSO4) einen dunkelblauen Komplex, ein Zeichen für einen mehrwertigen Alkohol. Glucose besitzt folgende Strukturformel (in der Fischer-Projektion):
Die Ringstruktur der Glucose
Ein Glucosemolekül kann durch eine intramolekulare nukleophile Addition ein zyklisches Halbacetal bilden:
Diese Form wird in der Haworth-Formel dargestellt, um die Bindungslängen korrekt darzustellen. Dabei steht das alleinstehende Sauerstoffatom rechts oben, die weiteren Kohlenstoffatome werden im Uhrzeigersinn nummeriert. Zudem muss man die Unterscheidung der zwei Formen – die zueinander diastomer sind – α-D-(+)-Glucose ($[\alpha]_D^{20} = +\,112\,^\circ$) und β-D-(+)-Glucose ($[\alpha]_D^{20} = +\,19\,^\circ$) beachten:
Solche Isomere eines Saccharids, die sich nur durch die Konfiguration an demjenigen Kohlenstoffatom unterscheiden, das erst bei der Ringbildung zu einem Chiralitätszentrum wird, bezeichnet man als Anomere und das betreffende Atom als anomeres Kohlenstoffatom.
Da die Glucose eine heterozyklische Sechsringstruktur besitzt, spricht man von der Pyranoseform. Traubenzucker liegt in fester Form ausschließlich in der Ringform vor, in wässriger Lösung zu 99,9% in der Ringform und zu 0,1% in der offenkettigen Form mit Aldehydgruppe vor (Fehling- und Silberspiegelprobe positiv).
Die Mutarotation der Glucose
Misst man den Drehwinkel einer Glucose-Lösung sofort nach dem Hinzugeben und drei Stunden später, erhält man folgendes Ergebnis:
| α-D-Glucose-Lösung | β-D-Glucose-Lösung | |
| sofortige Messung | $[\alpha]_D^{20} = +\,112\,^\circ$ | $[\alpha]_D^{20} = +\,19\,^\circ$ |
| Messung drei Stunden später | $[\alpha]_D^{20} = +\,52\,^\circ$ | $[\alpha]_D^{20} = +\,52\,^\circ$ |
In wässriger Lösung bildet sich über die offenkettige Form ein Gleichgewichtszustand mit 62% β-Glucose und 38% α-glucose aus, welcher den spezifischen Drehwinkel von +52° bedingt.
Es bildet sich mehr β-Glucose, da die β-Form stabiler ist als die α-Form, da die großen Hydroxidgruppen am anomeren und benachbarten Kohlenstoffatom den größtmöglichen Abstand besitzen und deshalb keine zusätzliche Ringspannung auftritt.
Fructose
Die Fructose, auch Fruchtzucker genannt, ist eine Ketohexose mit der Summenformel C6H12O6. Die Pyranoseform kommt in kristalliner Form sowie in wässrigen Lösungen außerhalb von Verbindungen vor:
Die β-D-Fructose besitzt einen spezifischen Drehwinkel von $[\alpha]_D^{20} = -\,133{,}5\,^\circ$ der Drehwinkel der α-D-Fructose ist nicht ermittelbar.
Furanoseform
Die Fructose bildet neben der Pyranose- auch die Furanoseform aus. Sie liegt jedoch nur in Verbindungen wie der Saccharose vor, bildet sich jedoch auch über eine nukleophile Addition zwischen der Carbonylgruppe und Hydroxygruppe des C5-Atoms:
Umlagerung in die Glucose
Die Fructose ist im schwach alkalischen Milieu in der Lage, sich in die Glucose umzulagern (und umgekehrt). Diese Umlagerung nennt man Keto-Endiol-Tautomerie. Die daran beteiligten Zucker sind sogenannte epimere Zucker.
Durch diese Umlagerung führen die Fehling- und Silberspiegelprobe zu einem positiven Ergebnis, da die entstandene Aldehydgruppe oxidiert wird und das Nachweisreagenz reduziert wird.
Maltose
Die Maltose ist ein Disaccharid und das Abbauprodukt der Stärke, das aus zwei Glucosemolekülen besteht. Diese sind über eine Sauerstoffbrücke verbunden, die durch die Reaktion zweier Hydroxygruppen entsteht. Man bezeichnet diese als glykosidische Bindung. Da sie zwischen dem C1-Atom mit der Hydroxygruppe in der α-Form und dem C4-Atom geknüpft wird, spricht man von einer α-1,4-glykosidischen Bindung.
Durch Mutarotation ist es möglich, dass sich der rechte Ringe öffnen kann, wodurch auch Moleküle in der offenkettigen Form vorliegen. Dadurch ist eine Aldehydgruppe vorhanden, die eine Fehling- oder Silberspiegelprobe positiv verlaufen lässt.
Cellobiose
Das Disaccharid Cellobiose erhält man, indem man Cellulose mit Säuren oder Laugen zerlegt. Sie besteht wie die Maltose aus zwei Glucosemolekülen, die am C1- und C4-Atom miteinander verknüpft sind. Das linke liegt jedoch in der β-Form vor, weshalb man die Bindung β-1,4-glykosidisch nennt.
Das das C1-Atom des rechten Glucosemoleküls nicht gebunden ist, kann es in die offenkettige Form übergehen; die Nachweisproben für Aldehyde verlaufen also positiv.
Saccharose
Die Saccharose ist ein Zweifachzucker bestehend aus α-D-Glucose und β-D-Fructose, die α,β-1,2-glycosidisch miteinander verbunden sind. Die Fructose liegt dabei in der Furanoseform vor. Da hier das Kohlenstoffatom, an dem die Carbonylgruppe hing, in der Bindung vorhanden ist, kann kein Ring geöffnet werden, weshalb die Silberspiegel- und Fehlingprobe negativ verlaufen.
Stärke
Amylose
Stärke, ein Polysaccarid, besteht aus zwei Formen. Eine ist die sogenannte Amylose, die aus 100-500 α-D-Glucosemolekülen, die α-1,4-glycosidisch verknüpft sind, bestehen und circa 20% Anteil hat. Sie bildet eine unverzweigte Kette, die sich aufgrund von Wasserstoffbrücken spiralig anordnen, wobei eine Windung aus sechs Glucoseeinheiten besteht.
In Wasser ist Amylose kollodial löslich. Zudem färbt sich Iod-Kaliumiodidlösung (braun) blau, da sich die Iod-Moleküle in die Spirale einlagern können. Dies erklärt den spezifischen Stärkenachweis durch Iod.
Amylopektin
Amylopektin hat einen Anteil von circa 80% und besteht aus mehr als 2000 α-D-Glucoseeinheiten. Es ist in Wasser unlöslich und bildet eine rot-violette Färbung mit Iod-Kaliumiodidlösung. Es ist ebenfalls α-1,4-glycosidisch verknüpft, bildet jedoch nach ungefähr 25 Einheiten eine zusätzliche α-1,6-glycosidische Bindung aus, wodurch eine verzweigte, strauchartige Struktur entsteht.
Cellulose
Cellulose ist die häufigste chemische Verbindung in Lebewesen.[1]Galvani Chemie Schülerbuch 11 S. 112 Sie ist Hauptbaustein der Zellwände grüner Pflanzen und besteht aus bis zu 20.000 β-D-Glucoseeinheiten, die β-1,4-glycosidisch verknüpft sind. Cellulose hat eine lineare Struktur. Mehrere solcher „Ketten“ bilden eine Fibrille, die sich wiederum zu einer Faser verdrillen, wodurch Stabilität, Reißfestigkeit und Wasserundurchlässigkeit gewährleistet werden.
Aminosäuren und Proteine
Aminosäuren
Aminosäuren (auch 2-Aminocarbonsäuren oder α-Aminocarbonsäuren) bilden die Bausteine für Proteine. Sie bestehen aus einem Kohlenstoffatom, an dem eine Carboxygruppe, eine Aminogruppe, ein Wasserstoffatom sowie ein Rest R hängen.
Sitzt die Aminogruppe dabei am C2-Atom, welches als α-Atom bezeichnet wird, spricht man von einer α-Aminosäure, sitzt sie am nächsten als β-Aminosäure etc. In Lebewesen kommen ausschließlich erstere vor.
Chiralität
Betrachtet man das α-Kohlenstoffatom (vgl. oben), so erkennt man, dass es ein Chiralitätszentrum ist (außer bei Glycin). Man kann sie ebenfalls in der Fischer-Projektion darstellen. Dabei befindet sich die Carboxygruppe oben und der Rest R unten. Befindet sich die Aminogruppe nun auf der linken Seite, spricht man von einer L-Aminosäure, ist sie auf der rechten, ist sie eine D-Aminosäure.
Der Rest wird dabei nach unten geschrieben, das einzelne Wasserstoffatom steht also rechts. In der Natur sind nur L-Aminosäuren vorhanden.
Eigenschaften
Alle Aminosäuren sind bei Raumtemperatur Feststoffe mit einem relativ hohen Schmelzpunkt. Sie lösen sich in polaren Lösungsmitteln wesentlich besser als in unpolaren, weshalb sie als Zwitterionen vorliegen.
Sie wirken zudem als Puffer, d.h. sie können den pH-Wert bei Zugabe von Oxonium- bzw. Hydroxidionen (nahezu) konstant halten.
Elektrophorese
Aminosäuren sind Ampholyte, d.h., dass sie als Basen und Säuren reagieren können. Der pH-Wert der Lösung wird dabei auch von dem Rest beeinflusst. Dies zeigt sich besonders, wenn im Rest eine Carboxy- oder Aminogruppe vorliegt und so in wässriger Lösung den pH-Wert senkt bzw. anhebt.
Der isoelektrische Punkt (IEP)
Je nach pH-Wert der Lösung liegt die Aminosäure also Anion, Zwitterion oder Kation vor. Der Wert, an dem die Aminosäure nahezu ausschließlich als Zwitterion vorliegt, wird als isoelektrischer Punkt genannt. Dieser ist für jede Aminosäure charakteristisch, da er von dem Rest abhängt.
Der IEP liegt im sauren Bereich, wenn die COOH-Gruppe etwas leichter das Wasserstoffatom als Proton abgibt als es die Aminogruppe aufzunehmen vermag (und umgekehrt). Am IEP ist zudem die Löslichkeit der Aminosäure am geringsten, da mehr Ladungsschwerpunkte vorliegen.
Trennungsverfahren
Die Charakteristika des IEPs und des Vorliegens der Aminosäure als Kation, Zwitterion oder Anion nutzt man bei der Elektrophorese aus. Dazu wird ein Gemisch aus Aminosäuren auf ein Trägermaterial gegeben und eine Gleichspannung angelegt.
Dadurch wandern die Kationen zum Minuspol und die Anionen zum Pluspol; ungeladene bleiben an ihrer Stelle. Zusätzlich wandern größere Moleküle langsamer. Wenn man die Aminosäuren mit Ninhydrin sichtbar gemacht hat, kann man erkennen, dass an verschiedenen Punkten sich die Moleküle befinden. Dadurch können sie getrennt und analysiert sowie „identifiziert“ werden.
Beispiel
| Aminosäure | IEP |
| Alanin | 6,0 |
| Lysin | 9,9 |
| Asparaginsäure | 3,0 |
In die Mitte eines Cellulose-Papiers, welches in eine Pufferlösung mit dem pH-Wert von 6 getränkt wurde, soll ein Aminosäuregemisch mit Alanin, Lysin und Asparaginsäure gegeben werden. Die isoelektrischen Punkte der Aminosäuren sind in Tab. 2 gegeben.
Durch den pH-Wert von 6 liegt Alanin als Zwitterion vor, da es beim IEP den gleichen Wert besitzt. Es wandert deshalb nicht, sondern richtet sich nur im elektrischen Feld aus.
Lysin liegt bei dem gegebenen pH-Wert in der Kationenform vor, da durch die im Vergleich zum IEP „saurer“, weshalb es ein Proton aufnimmt, wodurch als einzige Ladung die positive der Ammoniumgruppe bleibt. Lysin wandert deshalb in Richtung Kathode.
Asparaginsäure liegt in der Anionenform vor, weil die „basischere“ Umgebung (im Vergleich zum IEP) ein Proton der Ammoniumgruppe aufnimmt. Dadurch bleibt die negative Ladung an der Carboxylatgruppe übrig, weshalb das Molekül insgesamt negativ geladen ist. Es wandert deshalb in Richtung Anode.
Nachweisreaktionen von Aminosäuren
Biuret-Reaktion
Die Biuret-Reaktion verläuft im basischen Milieu. Dazu werden der Probe Cu2+-Ionen zugesetzt. Häufig werden dazu Natronlauge und Kupfer(II)-sulfatlösung verwendet. Ist die Probe proteinhaltig, färbt sich die Lösung violett.
Ninhydrin-Reaktion
Möchte man wissen, ob Aminosäuren vorliegen, wird oft die Ninhydrin-Reaktion herangezogen. Durch Angreifen endständiger Aminogruppen färbt sich die Lösung beim Erwärmen blau-violett.
Xanthoprotein-Reaktion
Gibt man konzentrierte Salpetersäure in die Probelösung, färbt sie sich gelb, da aromatische Reste nitriert werden. Da in Proteinen immer aromatische Aminosäuren vertreten sind, ist dieser Test sehr zuverlässig.
Proteine
Peptidbindung
Ein Protein besteht aus einer großen Zahl von Aminosäuren. Diese verknüpfen sich über eine Kondensationsreaktion. Bei dieser wird je ein Wassermolekül frei und es bildet sich eine Peptidbindung zwischen der Carboxy- und der Aminogruppe. Durch weitere Polykondensationsreaktionen werden die Ketten länger.
Der Abstand zwischen dem Stickstoff- und Kohlenstoffatom der Peptidbindung ist kleiner als bei einer „gewöhnlichen“ Bindung zwischen diesen Atomen. Dies ist damit erklärbar, dass die Bindungen der Peptidbindung mesomeriestabilisiert sind. Dadurch sind sie auch nicht frei beweglich und alle beteiligten Atome befinden sich in einer Ebene.
Strukturebenen von Proteinen
Primärstruktur
Die Reihenfolge eines Proteins bestimmt dessen Funktionsweise. Dabei ist die exakte Anordnung wichtig, da sonst die Funktionsweise sogar aufgehoben werden könnte. Diese Anordnung nennt man Aminosäuresequenz, die die Primärstruktur darstellt.
Sekundärstruktur
In Proteinen bilden die CO- und NH-Gruppen zwischenmolekulare Kräfte aus. Dadurch haben Proteine keinen linearen Aufbau. Diese Sekundärstruktur gliedert sich vor allem in die Faltblattstruktur und in die Helixstruktur.
Bei der Faltblattstruktur liegen zwei Molekülketten parallel nebeneinander und ordnen sich an, wie ein gefaltetes Blatt, da die Peptidbindungen planar sind, während das verbindende Kohlenstoffatom zwischen diesen die Bindungen tetraedrisch anordnet. Dadurch befinden sich die Reste außerhalb dieser Ebene.
Bei der Helixstruktur werden Wasserstoffbrückenbindungen zwischen einer Peptidbindung zur drittnächsten ausgebildet, indem die Aminosäureketten eingedreht werden. Dadurch ergibt sich eine geschraubte Struktur, wie sie zum Beispiel in der DNA vorkommt.
Tertiärstruktur
Durch die verschiedenen Reste kommt es zu weiteren zwischenmolekularen Kräften, die zu einer weiteren Anordnung führen. Diese Tertiärstruktur gibt dem Protein seine charakteristische Form, wodurch es arbeiten kann.
Die Tertiärstruktur kann dabei auf verschiedene Weisen ausgelöst werden:
- Disulfidbrücken (Atombindungen zwischen Schwefelatomen zweier Cystein-Reste)
- Wasserstoffbrückenbindungen
- Van-der-Waals-Kräfte
- Dipol-Dipol-Wechselwirkungen
- Ionenbindungen
Quartärstruktur
Die Quartärstruktur bildet sich aus der Anordnung mehrerer Proteine, die zusammen eine funktionelle Einheit bilden. Sie werden durch die gleichen Kräfte wie bei der Tertiärstruktur zusammengehalten und ermöglichen so die Funktionsweise.
Biologische Bedeutung
Schutz- und Abwehrfunktion
Der Körper wird durch zahlreiche Dinge wie UV-Strahlung, Viren, Bakterien usw. angegriffen. Deshalb gibt es verschiedene „Verteidigungssystem“, die ihn schützen sollen. So bildet die Haut, die größtenteils aus Keratin besteht, eine dieser Systeme.
Proteine werden auch eingesetzt, wenn eine Abwehr erforderlich ist, also z.B. ein Virus in den Körper eingedrungen ist. Dazu werden die sogenannten Antikörper benötigt, die meistens eine Y-förmige Quartärstruktur besitzen und sich durch das Schlüssel-Schloss-Prinzip an bestimmte Fremdkörper anhängen und dann abgebaut werden können.
Motorische Funktion
Bei der Bewegung von Muskeln sind die zwei Proteine Actin und Myosin wichtig. Letzteres bildet wie Actin Stränge, jedoch hängen am Ende „Köpfchen“. Diese verschiedenen Proteine liegen im Muskel nebeneinander und können sich wegen diesem Köpfchen unter Energieverbrauch bewegen.
Steuerfunktion
Enzyme können Reaktionen beschleunigen, weshalb sie auch Biokatalysatoren genannt werden. Sie können Stoffwechselvorgänge freigeben oder blockieren, wenn dies erforderlich ist.
Reaktionsgeschwindigkeit und Enzymkatalyse
Reaktionsgeschwindigkeit
Definition
Reaktionen verlaufen in unterschiedlichen Geschwindigkeiten. Während etwa der Rostvorgang eine sehr langsam verlaufende Reaktion ist, ist die Reaktion zwischen Wasserstoff und Sauerstoff bei der Knallgasprobe sehr schnell.
Diese Unterschiede lassen sich mit der Reaktionsgeschwindigkeit $v_R$ ausdrücken. Sie ist definiert als die Änderung der Stoffmenge $n$ in einer bestimmten Zeit $t$:
Versuch zur Ermittlung der Reaktionsgeschwindigkeit
Dies lässt sich etwa an folgendem Versuch darstellen:
Lässt man 8 ml Salzsäure (1 mol · l-1) circa 15 Minuten auf eine Spatelspitze Zink einwirken und fängt man den entstehenden Wasserstoff in einem Kolbenprober auf, kann man das Wasserstoffvolumen ablesen. Diese Werte ergeben folgendes Diagramm:
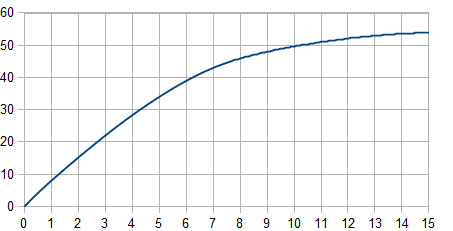
Durchschnittsgeschwindigkeit
Die Durchschnittsgeschwindigkeit $\overline{v_R}$ ist der Quotient aus der Volumenänderung und den zwei Zeitpunkten $t_1$ und $t_2$. Werden die Bedingungen nicht geändert, d.h. der Druck und die Temperatur bleiben konstant, verhält es sich bei den Stoffmengen proportional:
Momentangeschwindigkeit
Möchte man die Geschwindigkeit zu einem bestimmten Zeitpunkt, also die sogenannte Momentangeschwindigkeit ermitteln, nähert man die zwei Zeitpunkte immer weiter an. Die mittlere Geschwindigkeit des kleinstmöglichen Zeitabschnitts $\Delta t$ ist dann die Momentangeschwindigkeit.
Beschreibung der Reaktionsgeschwindigkeit
Um die Reaktionsgeschwindigkeit zu ermitteln, verwendet man entweder das Edukt oder das Produkt. Gewählt wird, was leichter zu messen ist. Da Masse und Volumen direkt proportional zur Stoffmenge sind, können die Zunahme der Produkte oder die Abnahme der Edukte herangezogen werden:
Stoßmodell
Beispiel: Bildung von Wasserstoffiodid
Die Teilchen bewegen sich mit einer bestimmten Energie frei im Raum; zu einer Reaktion kann es kommen, wenn zwei Teilchen zusammenstoßen. Allerdings führt nicht jeder Zusammenstoß zu einer Reaktion. Dies kann zwei Gründe haben:
- Die Teilchen stoßen ohne die richtige gegenseitige Orientierung zusammen oder
- Sie besitzen nicht die notwendige Aktivierungsenergie
Anhang: Aminosäuren in Proteinen
Allgemeines
In der Natur gibt es über 700 Aminosäuren. Hiervon kommen gleichwohl nur 20 in Proteinen vor. Sie werden als proteinogene Aminosäuren bezeichnet. Unter normalen Umständen kann der menschliche Körper zwölf Aminosäuren selbst herstellen. Die übrigen acht müssen aber über die Nahrung aufgenommen werden; sie werden als essentielle Aminosäuren bezeichnet.
Alle proteinogenen Aminosäuren folgen einem einheitlichen Bauplan: Am zentralen α-Kohlenstoffatom sind immer eine Aminogruppe, eine Carboxylgruppe sowie ein Wasserstoffatom gebunden. Daneben gibt es einen Rest R, der für jede Aminosäure verschieden ist. Mit Ausnahme des Glycins hat das zentrale Kohlenstoffatom daher vier verschiedene Substituenten und ist somit ein Chiralitätszentrum. Die Aminosäuren können somit als L- oder D-Enantiomer vorliegen[1]Königshoff/Brandenburger, S. 85.. In Proteinen kommt aber nur die L-Konfiguration vor.
Gruppierung der Aminosäuren nach ihrem Aufbau
Die Aminosäuren lassen sich sowohl nach ihrem Aufbau als auch nach ihren Eigenschaften sortieren. Im Folgenden soll eine Gruppierung nach ihrem Aufbau erfolgen.
Aliphatische Aminosäuren ohne weitere funktionelle Gruppen
| Strukturformel | |||||
| Trivialname | Glycin | L-Alanin | L-Valin | L-Leucin | L-Isoleucin |
| Ein-Buchstaben-Symbol | G | A | V | L | I |
| Drei-Buchstaben-Symbol | Gly | Ala | Val | Leu | Ile |
Die aliphatischen Aminosäuren zeichnen sich dadurch aus, dass sie nur eine Kohlenstoffkette besitzen und damit unpolar sind[2]Königshoff/Brandenburger, S. 86.. Daneben findet sich in dieser Gruppe auch das Glycin, das als einzige proteinogene Aminosäure keine Enantiomerie hat.
Aminosäuren mit Hydroxylgruppen
| Strukturformel | |||||
| Trivialname | L-Serin | L-Threonin | |||
| Ein-Buchstaben-Symbol | S | T | |||
| Drei-Buchstaben-Symbol | Ser | Thr | |||
Serin und Threonin sind wegen ihrer Hydroxylgruppe im Rest schwach hydrophil, nach außen hin aber neutral.
Saure Aminosäuren und deren Amide
| Strukturformel | |||||
| Trivialname | L-Asparaginsäure | L-Asparagin | L-Glutaminsäure | L-Glutamin | |
| Ein-Buchstaben-Symbol | D | N | E | Q | |
| Drei-Buchstaben-Symbol | Asp | Asn | Glu | Gln |
Basische Aminosäuren
| Strukturformel | |||||
| Trivialname | L-Lysin | L-Arginin | L-Histidin | L-Cystein | L-Methionin |
| Ein-Buchstaben-Symbol | K | R | H | C | M |
| Drei-Buchstaben-Symbol | Lys | Arg | His | Cys | Met |
Cyclische Aminosäuren
Das Prolin ist die einzige cyclische Aminosäure. Diese Gruppe kann man daher auch schlicht als „Iminosäure“ bezeichnen. Bei ihr bildet der Rest mit dem α-Kohlenstoffatom und der Aminogruppe einen Fünfring (Iminring)[3]Königshoff/Brandenburger, S. 86..
Aromatische bzw. heteroaromatische Aminosäuren
| Strukturformel | |||||
| Trivialname | L-Phenylalanin | L-Tyrosin | L-Tryptophan | ||
| Ein-Buchstaben-Symbol | F | Y | W | ||
| Drei-Buchstaben-Symbol | Phe | Tyr | Trp | ||
Die aromatischen bzw. heteroaromatischen Aminosäuren haben in ihrem Rest einen aromatischen Ring. Dabei ist Phenylalanin unpolar, Tyrosin und Tryptophan sind dagegen aufgrund ihrer OH- bzw. NH-Gruppe schwach polar[4]Stryer, S. 50..
Die essentiellen Aminosäuren
| Essentielle Aminosäure | Empfohlene Tagesmenge[5]Die empfohlene Tagesdosis bezieht sich auf die Körpermasse eines gesunden Erwachsenen; WHO, S. 150. | Bedeutung (nicht abschließende Aufzählung) |
| Isoleucin | 20 mg/kg | Dient als Baustein für den Proteinaufbau und kann auch für die Energiegewinnung in Muskelzellen verwendet werden. |
| Leucin | 39 mg/kg | Wird für den Aufbau und Erhalt von Muskelgewebe benötigt und hemmt den Abbau von Muskelprotein. Unterstützt daneben die Proteinbiosynthese in der Muskulatur und in der Leber sowie bei Heilungsprozessen. |
| Lysin | 30 mg/kg | Ist wichtig für die Proteinbiosynthese und den Strukturerhalt in Proteinen und Kollagen. Ebenso bedeutsam für die epigenetische Regulation durch eine Modifikation der Histone. |
| Methionin | 10 mg/kg (mit Cystein 15 mg/kg) | Wird für die Herstellung von der nicht-essentiellen Aminosäure Cystein, von Adrenalin benötigt. Es ist zudem die bedeutendste Quelle für die Produktion von Cholin. |
| Phenylalanin | 25 mg/kg (mit Tyrosin) | Die benötigte Menge hängt (auch) davon ab, wie viel Tyrosin aufgenommen wird. Es hat eine wichtige Rolle beim Stickstoffstoffwechsel und ist an der Synthese wichtiger Neurotransmitter (u. a. Adrenalin, Noradrenalin, Dopamin) und anderer Stoffe (z. B. Melanin) beteiligt. |
| Threonin | 15 mg/kg | Ist ein wichtiger Teil der Immunabwehr und für den Aufbau der Schleimhäute notwendig. Threonin wird zudem für den Aufbau von Kollagen benötigt. Es dient auch zur Weitstellung von Blutgefäßen, was eine verbesserte Durchblutung bedingt[6]natursubstanzen.com, S. 1.. |
| Tryptophan | 4 mg/kg | Es ist am Aufbau verschiedener Proteine sowie an der Synthese mehrerer Botenstoffe (z. B. Serotonin, Melatonin) beteiligt. Daneben ist ein Provitamin für Vitamin B3. |
| Valin | 26 mg/kg | Wird für die Proteinbiosynthese benötigt und kann gegebenenfalls zur Energiegewinnung genutzt werden. Es ist an der Regulation des Blutzuckers beteiligt. |
Literatur und Quellen
Literatur
- Galvani Chemie Schülerbuch 11 S. 40, Oldenbuch Schulverlag, München, 1. Auflage, 2009
ISBN: 978-3-7627-0172-9 - Königshoff, Melanie/Brandenburger, Timo: Kurzlehrbuch Biochemie, Georg Thieme Verlag,
3. Auflage 2012, ISBN 9783131364135
(zitiert als: Königshoff/Brandenburger, S. ...). - Stryer, Lubert/Berg, Jeremy M./Tymoczko, John L.: Biochemie, Spektrum Akademischer Verlag,
5. Auflage 2003, ISBN 9783827413036
(zitiert als: Stryer, S. ...). - Protein and amino acid requirements in human nutrition,
in: World Health Organization technical report series, 2007 (935)
(zitiert als: WHO, S. ...).
Quellen
- Farbstoffe
- ↑http://commons.wikimedia.org, David Hall
- ↑Galvani Chemie Schülerbuch 11 S. 40
- Kunststoffe
- ↑ebd., S. 54
- Lipide und Tenside
- ↑http://commons.wikimedia.org, Pfünder
- ↑http://commons.wikimedia.org, Anderl
- Kohlenhydrate und Stereochemie
- ↑Galvani Chemie Schülerbuch 11 S. 112
- Anhang: Aminosäuren in Proteinen
- ↑Königshoff/Brandenburger, S. 85.
- ↑Königshoff/Brandenburger, S. 86.
- ↑Königshoff/Brandenburger, S. 86.
- ↑Stryer, S. 50.
- ↑Die empfohlene Tagesdosis bezieht sich auf die Körpermasse eines gesunden Erwachsenen; WHO, S. 150.
- ↑natursubstanzen.com, S. 1.