- Organische Chemie
- Was ist die organische Chemie?
- Kohlenstoff als Bindungspartner
- Alkane
- Homologe Reihe der Alkane
- Benennung der Alkane
- Regeln zur Ermittlung des Namens
- Beispiel
- Alkene
- Einführung
- Primäre, sekundäre, tertiäre und quartäre Kohlenstoffatome
- Alkine
- Isomere Verbindungen
- E/Z-Isomerie
- Physikalische Eigenschaften der Alkane
- Siede- und Schmelztemperaturen von unverzweigten Alkanen
- Siedetemperaturen von isomeren Molekülen
- Löslichkeit
- Brennbarkeit der Kohlenwasserstoffe
- Halogenierung von Alkanen
- Wiederholung
- Radikalische Substitution
- Beispiel: Bromierung von Heptan
- Vorgang der Radikalischen Substitution
- Die elektrophile Addition
- Einführung
- Reaktionsmechanismus
- 1. Schritt: Polarisierung des Halogenmoleküls
- 2. Schritt: Anlagerung des ersten Bromatoms
- 3. Schritt: Anlagerung des zweiten Bromatoms
- Halogenalkane
- Allgemeines
- Ökologische Bedeutung
- Allgemeines
- Ozon (O3)
- Bildung von Ozon am Boden
- Sommersmog
- Auswirkungen des bodennahen Ozons
- Die Ozonschicht in der Stratosphäre
- Polymerisation – vom Monomer zum Polymer
- Vorgang der Polymerisation
- Wichtige und häufige Polymere
- Alkanole
- Homologe Reihe der Alkanole
- Nomenklatur
- Stellungsisomerie
- Funktionelle Gruppe
- Mehrwertige Alkanole
- Vielfältigkeit von Alkanolen
- Eigenschaften
- Hydroxygruppe und zwischenmolekulare Kräfte
- Homologe Reihe und Löslichkeit
- Reaktionen von Alkanolen
- Oxidation
- Vorgehen zum Lösen von Redoxreaktionen mit Alkanolen
- Funktionelle Gruppen sauerstoffhaltiger organischer Verbindungen
- Aldehyde und Ketone
- Nachweisreaktionen der Aldeyhde
- Fehlingprobe
- Silberspiegelprobe/Tollensprobe
- Eigenschaften
- Eigenschaften der Aldehyde
- Eigenschaften der Ketone
- Benennung von Aldehyden und Ketonen
- Reaktionen der Aldehyden und Ketonen
- Einführung
- Reaktionsmechanismus der nukleophilen Addition
- 1. Schritt
- 2. Schritt
- 3. Schritt
- Produkt der nukleophilen Addition
- Besondere Carbonylverbindungen
- Alkansäuren und Ester
- Alkansäuren reagieren sauer
- Homologe Reihe
- Ester
- Verschiebung
- Benennung
- Proteine
- Aminosäuren: Bausteine der Proteine
- Aminosäuren: Zwitterionen
- Aminosäuren: Puffereigenschaften
- Quellen
Organische Chemie
Während in der achten und neunten Klasse sich mit der anorganischen Chemie auseinandergesetzt worden ist, ist in der zehnten Klasse die organische Chemie das Hauptthema. Es soll hier deshalb erläutert werden, was dies ist und welche Bedeutung ihr im Allgemeinen zukommt.
Was ist die organische Chemie?
Die Unterscheidung zwischen der anorganischen und organischen Chemie geht auf den Chemiker Jöns Jakob Berzelius (1779–1848) zurück. Dabei ging er davon aus, dass organische Verbindungen, zu denen z. B. Zucker, Eiweiße, Fette gehören, ausschließlich von Lebewesen hergestellt werden könnten. 1828 wurde aber von einem Schüler Berzelius, Friedrich Wöhler, künstlich eine organische Verbindung (Harnstoff) hergestellt.
Die organische Chemie befasst sich mit den chemischen Verbindungen, die auf Kohlenstoff basieren. Dabei bildet der Kohlenstoff Moleküle mit anderen Elementen, hauptsächlich mit Wasserstoff, Sauerstoff und Stickstoff oder auch einzelnen Halogenen.
Durch seine besondere Struktur ist der Kohlenstoff wie kein anderes Element in der Lage langkettige und große Moleküle aufzubauen, die die Basis für das komplette, uns bekannte Leben darstellen.
Viele organische Verbindungen sind hitzeempfindlich und leicht brennbar. Unter Luftabschluss bilden sich beim Erhitzen häufig schwarze Reaktionsprodukte. Zudem haben viele organische Moleküle einen charakteristischen Geruch. Es sei aber daran erinnert, dass bei Geruchsproben Vorsicht zu walten ist.
Kohlenstoff als Bindungspartner
Warum der Kohlenstoff ein solch guter Bindungspartner für die anderen Elemente ist, lässt sich gut erkennen, wenn man dessen Elektronenkonfiguration betrachtet:
In der Darstellung erkennt man, dass der Kohlenstoff zwei halb besetzte Orbitale hat. Mit diesen kann der Kohlenstoff kovalente Bindungen ausbilden. Betrachtet man jedoch Moleküle wie Methan (siehe rechts), erkennt man, dass ein Kohlenstoffatom in der Lage ist, vier Bindungen auszubilden.
Diesen Zustand kann man jedoch erreichen, indem man ein Elektron des 2s-Orbitals durch Energiezufuhr anregt. Dadurch befindet sich dieses im 2pz-Orbital. Man hat damit also vier halb besetzte Orbitale, die alle Bindungen eingehen können.
Durch diese große Anzahl an Bindungsmöglichkeiten können sich die Kohlenstoffatome mit weiteren zu kettenförmigen oder sogar kugelförmigen Molekülen verbinden.
Sind nicht nur Kohlenstoffatome in einem Molekül vorhanden (wie bei Graphit oder Diamanten), sondern auch unter anderem Wasserstoff, spricht man von Kohlenwasserstoffen. Diese lassen sich wiederum in mehrere Gruppen einteilen, die im Folgenden erläutert werden.
Alkane
Alkane sind Kohlenwasserstoffe, deren einzige Bestandteile Kohlenstoff und Wasserstoff sind. Jedes Kohlenstoffatom geht dabei genau vier Einfachbindungen ein. Es kann daher mit keinen weiteren Atomen verknüpft werden. Deshalb sind Alkane gesättigte Kohlenwasserstoffe.
Homologe Reihe der Alkane
Durch diesen grundlegenden Aufbau ergibt sich eine homologe Reihe, die sich an der Anzahl der Kohlenstoffatome orientiert. Die ersten Moleküle dieser Reihe sind folgende:
| Methan | Ethan | Propan | Butan | Pentan |
| Hexan (C6H14) | Heptan (C7H16) | Octan (C8H18) | Nonan (C9H20) | Decan (C10H22) |
Man erkennt leicht, dass man die Kette durch den Einschub einer CH2-Gruppe (Methylengruppe) verlängern kann. Die allgemeine Strukturformel für ein kettenförmiges Alkan lautet daher:
Ermittelt man die Summenformeln der Alkane, also die Zusammenfassung auf die bloße Anzahl der einzelnen Atome, erhält man (für Methan bis Hexan) die Ergebnisse CH4, C2H6, C3H8, C4H10, C5H12, C6H14. Allgemein lässt sich sagen, dass eine n-lange Kette die Formel CnH2n+2 besitzt.
Benennung der Alkane
Das zentrale Gremium für die Benennung von chemischen Verbindungen ist die IUPAC („International Union of Pure and Applied Chemistry“). Ihre Vorgaben für die Nomenklatur von chemischen Verbindungen sind einzuhalten.
Regeln zur Ermittlung des Namens
- Zuerst wird die längste durchgehende Kette aus Kohlenstoffatomen ermittelt. Diese Kette kann auch „Knicke“ enthalten. Aus der Anzahl der Kohlenstoffatome ergibt sich die Endung des Namens (z.B. „-butan“).
- Als nächstes werden die Seitenketten nach der Anzahl der Kohlenstoffatome benannt; sie bekommen die Endung „-yl“ (z.B. -CH3: Methylgruppe, C2H5, Ethylgruppe).
- Die Namen der Seitenkette werden dem Namen der Hauptgruppe alphabetisch vorangestellt; eine Ethylgruppe kommt also vor eine Methylgruppe.
- Man ermittelt die Anzahl der gleichen Seitenketten und kennzeichnet sie bei wiederholtem Vorkommen durch das entsprechende griechische Zahlwort (also 2 = di, 3 = tri, etc.).
- Abschließend werden die Verknüpfungsstellen zwischen Haupt- und Seitenketten ermittelt; dabei wird die Hauptkette so durchnummeriert, dass die Verknüpfungsstellen kleinstmögliche Zahlen erhalten. Kommt eine Seitenkette häufiger vor, schreibt man die Verknüpfungsstelle durch ein Komma getrennt direkt hintereinander.
Beispiel
Zur Verdeutlichung soll das Molekül rechts benannt werden. Dafür werden die oben beschriebenen Schritte nochmals einzeln durchgegangen.
- Die längste Kette sind die horizontal dargestellten Kohlenstoffatome. Sie ist sieben Atome lang. Das Molekül erhält daher die Endung „-heptan“.
- Wir haben insgesamt drei Seitenketten. Zwei sind Methylgruppen (-CH3); die dritte ist eine Ethylgruppe(-C2H5).
- Sie werden alphabetisch vorangestellt. Man erhält damit „Ethyl-methylheptan“.
- Nun wird bei der Methylgruppe ein „di“ vorangestellt, da zwei solcher Seitenketten vorliegen. Die Ethylgruppe benötigt kein Präfix. Dadurch hat man bis jetzt „Ethyl-dimethylheptan“.
- Zum Schluss werden die Nummern der Verknüpfungsstellen ermittelt. Hier bekommt das Kohlenstoffatom, an dem die beiden Methylgruppen hängen, die drei. Damit erhält man als abschließenden Namen „4-Ethyl-3,3-dimethylheptan“.
Alkene
Einführung
von Ethen
Befindet sich in einem Kohlenwasserstoffmolekül auch eine oder mehrere Doppelbindungen, so spricht man von Alkenen. Bei der Namensgebung sind die Regeln der Alkane zu beachten, wobei anstelle der Endung -an die Endung -en verwendet wird, z.B. Ethen, Propen.
Außerdem hat die Mehrfachbindung die höhere Priorität, das heißt, dass die Nummerierung der Kohlenstoffkette so zu wählen ist, dass das Kohlenstoffatom, von dem die Mehrfachbindung ausgeht, die kleinstmögliche Zahl erhält. Vor die Endung „-en“ wird dabei die Stelle der Doppelbindung angegeben.
Primäre, sekundäre, tertiäre und quartäre Kohlenstoffatome
Die Kohlenstoffatome können in primäre, sekundäre, tertiäre und quartäre unterteilt werden. Als Beispiel dient das rechts stehende Molekül 2,4,4,5-Tetramethylhept-2-en.
Das erste Kohlenstoffatom (C1) ist ein sogenanntes primäres Kohlenstoffatom, weil es mit einem weiteren Kohlenstoffatom verbunden ist. Dementsprechend ist das C6 ein sekundäres Kohlenstoffatom (verbunden mit zwei Kohlenstoffatomen), C5 ein tertiäres Kohlenstoffatom (drei Kohlenstoffatome) und C4 ein quartäres Kohlenstoffatom (vier Kohlenstoffatome).
Alkine
Des Weiteren gibt es Alkine. Sie sind Kohlenwasserstoffe, die mindestens eine Dreifachbindung haben. Ebenso wie bei den Alkenen sind bei der Benennung die oben genannten Regeln zu beachten. Die Moleküle erhalten als Endung ein „-in“. So hat das Molekül mit der Summenformel C2H2 den Namen Ethin (rechts dargestellt).
Isomere Verbindungen
Besitzen Alkane mehr als drei Kohlenstoffatome, so können sie nicht nur unverzweigte, sondern auch verzweigte Ketten bilden.
Als Beispiel dienen hier die zwei möglichen Formen, in denen Butan, also ein Molekül mit vier Kohlenstoffatomen und 10 Wasserstoffatomen, vorkommen kann: n-Butan (die unverzweigte Verbindung) und 2-Methylpropan.
| Strukturformel von n-Butan | Strukturformel von 2-Methylpropan |
n-Butan und 2-Methylpropan (=Isobutan) sind Isomere, da sie bei gleicher Anzahl von Atomen unterschiedlich miteinander verknüpft sind. Die beiden Moleküle haben voneinander verschiedene Konstitutionen und unterschiedliche Eigenschaften.
Man spricht bei unterschiedlicher Reihenfolge der Atome von Konstitutionsisomerie (Strukturisomerie).
E/Z-Isomerie
Bei But-2-en tritt eine weitere Art von Isomerie auf. Dazu muss man den Molekülbau genauer betrachten. Vergleicht man Butan mit But-2-en, so erkennt man, dass bei ersterem an allen Einfachbindungen eine freie Drehbarkeit um die C-C-Bindungsachse möglich ist.
Bei But-2-en ist an der Doppelbindung zwischen dem zweiten und dritten Kohlenstoffatom keine Drehbarkeit mehr vorhanden:
| Z-But-2-en | E-But-2-en |
Wie man erkennt, stehen beim Z-Isomer beide Methylgruppen auf der gleichen Seite der Doppelbindung (Z = zusammen). Beim E-Isomer befinden sich die Methylgruppen auf gegenüberliegenden Seiten (E = entgegen). Man kann diese E/Z-Isomerie auch als cis/trans-Isomerie bezeichnen.
Diese Art der Isomerie kann nur auftreten, wenn
- eine Doppelbindung vorliegt und
- sich an jedem der beiden Kohlenstoffatome der Doppelbindung je zwei verschiedene Atome oder Atomgruppen befinden.
Physikalische Eigenschaften der Alkane
Siede- und Schmelztemperaturen von unverzweigten Alkanen
Die homologe Reihe der Alkane weist steigende Schmelz- und Siedetemperatur auf. Diese Temperaturen hängen von der Art und der Anzahl der zwischenmolekularen Kräfter ab.
Durch die nur vorhandenen Kohlenstoff-Wasserstoff-Bindungen, sind nur geringe Polaritäten wegen der geringen Unterschiede in der Elektronegativität vorhanden. Durch die tetraedrische Anordnung der Bindungspartner um das Kohlenstoffatom sind Alkane auch keine Dipole. Es treten daher nur Van-der-Waals-Kräfte und induzierte Dipole zwischen Alkanen auf.
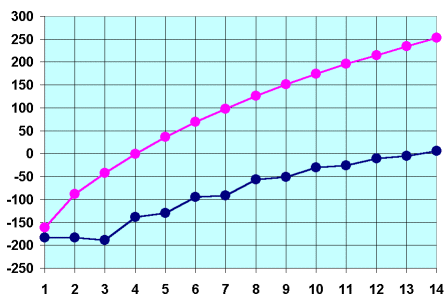
Das nebenstehende Diagramm zeigt, dass mit wachsender Kettenlänge (und damit wachsender Oberfläche), die Schmelz- und Siedetemperaturen steigen, da hierbei die Entstehung von Polarisierungsmöglichkeiten zunimmt. Dadurch nehmen auch die zwischenmolekularen Kräfte zu.
Bei höheren Alkanen (ab etwa 20 Kohlenstoffatomen), sind die Anziehungskräfte zwischen den Molekülen so groß, dass bei entsprechender Energiezufuhr die Bindungen im Alkanmolekül gespalten werden, bevor die Van-der-Waals-Kräfte aufgehoben werden, was zur Folge hat, dass eine Zersetzung unterhalb der Siedetemperatur stattfindet.
Siedetemperaturen von isomeren Molekülen
Nimmt man die isomeren Pentanmoleküle und betrachtet ihre Siedetemperaturen, so erhält man folgende Werte: n-Pentan: 36°C, 2-Methylbutan: 28°C, 2,2-Dimethylpropan: 10°C.
Die Ursache in den unterschiedlichen Siedetemperaturen liegt darin, dass das unverzweigte n-Pentan eine große Oberfläche besitzt (stärkere Van-der-Waals-Kräfte) und 2,2-Dimethylpropan einen fast kugelförmigen Bau hat (und damit eine kleine Oberfläche). Die intermolekularen Kräfte (und damit die Siedetemperaturen) nehmen also von n-Pentan zu 2,2-Dimethylpropan ab.
Löslichkeit
Alle Alkane sind ineinander löslich. Sie gehen jedoch keine Lösung mit Wasser ein und sind damit hydrophob, da zwischen polaren Wassermolekülen Wasserstoffbrückenbindungen bestehen und zwischen den unpolaren Alkanmolekülen Van-der-Waals-Kräfte. Dadurch sind sie jedoch in Fett löslich, also lipophil.
Brennbarkeit der Kohlenwasserstoffe
Alkane, Alkene und Alkine reagieren mit Sauerstoff und verbrennen zu Wasser und Kohlenstoffdioxid:
- Verbrennung von Alkanen:
$ \mathrm{2\,C_2H_6 + 7\,O_2 \;\longrightarrow\; 4\,CO_2 + 6\,H_2O} $
- Verbrennung von Alkenen:
$ \mathrm{C_2H_4 + 3\,O_2 \;\longrightarrow\; 2\,CO_2 + 2\,H_2O} $
- Verbrennung von Alkinen:
$$ \mathrm{2\,C_2H_2 + 5\,O_2 \;\longrightarrow\; 4\,CO_2 + 2\,H_2O} $$
In der homologen Reihe der Alkane nimmt das Leuchten der Flamme mit Steigern der Anzahl an Kohlenstoffatomen zu. Bei gleicher Luftzufuhr findet zunehmend eine unvollständige Verbrennung statt. Dies liegt daran, dass durch die erhöhte Anzahl nicht jeder Kohlenstoff einen Reaktionspartner „findet“.
Verbrennt man Ethin (auch Acetylen genannt), entsteht eine stark leuchtende Flamme; bei der Verbrennung mit reinem Sauerstoff erhält man eine helle, heiße Flamme von bis zu 3000°C, mit der man sogar Stahl schmelzen kann.
Halogenierung von Alkanen
Wiederholung
Spaltet man ein Chlormolekül, so vollzieht man eine homolytische Spaltung. Man erhält zwei Chloratome mit einem freien Elektron. Sie sind daher sehr reaktionsfreudig und werden als Radikale bezeichnet. Die Spaltung von Wasserstoffchlorid vollzieht sich heterolytisch.
Radikalische Substitution
Ersetzt man ein Wasserstoffatom in einem Kohlenwasserstoffmolekül durch einen anderen Bindungspartner (einem Atom oder einer Atomgruppe),spricht man von einer Substitution. Eine typische Reaktion der Alkane ist die radikalische Substitution.
Beispiel: Bromierung von Heptan
Man möchte Heptan bromieren, also ein Wasserstoffatom durch ein Bromaton ersetzen. Gibt man hierzu einige Tropfen Brom zu Heptan, so entfärbt sich die Lösung, das heißt, das Brom hat mit dem Alkan reagiert. Über der Flüssigkeit erfolgt in feuchter Luft eine Nebelbildung: Es hat sich Bromwasserstoff gebildet.
Es entsteht allgemein bei jeder Substitution neben dem halogenierten Produkt immer das entsprechende Wasserstoffhalogenid. Lässt man zum Beispiel Methan mit Chlor reagieren, entsteht Tetrachlorkohlenstoff und Chlorwasserstoff.
Vorgang der Radikalischen Substitution
Bei der radikalischen Substitution wird ein Halogenmolekül gespalten; dadurch entsteht ein Halogenradikal. Dies ist die Startreaktion. Ein Alkan reagiert mit einem Halogenmolekül zu einem Alkylradikal (ein Wasserstoffatom wurde entfernt) und einem Wasserstoffhalogenid (z.B. HBr). Das Alkylradikal und ein weiteres Halogenmolekül reagieren dann zu Halogenalkanen und Halogenradikalen.
Abbruchreaktionen, also Reaktionen, die dazu führen, dass die Substitution nicht mehr erfolgt, können folgende sein:
- Halogenradikale reagieren zu Halogenmolekülen
- zwei Alkylradikale reagieren zu einem Alkan
- ein Alkylradikal und ein Halogenradikal reagieren zu Halogenalkan
Die elektrophile Addition
Einführung
Alkene und Alkine können – im Gegensatz zu Alkanen – die so genannte elektrophile Addition mit Halogenmolekülen eingehen. Wie bereits der Name sagt, wird hier nichts ersetzt, sondern ergänzt. Dabei lagert sich das Halogen an die Stelle an, an der die Doppelbindung war, indem es diese aufbricht:
Hier wurde Ethen bromiert. Es entsteht dabei 1,2-Dibromethan. Dies ist auch eine Nachweisreaktion für ungesättigte Kohlenwasserstoffe: Das braune Bromwasser entfärbt sich bei Anwesenheit dieser.
Reaktionsmechanismus
Im Folgenden wird der Reaktionsmechanismus im Einzelnen dargestellt. Rechts wird er auch Schritt für Schritt erläutert.
1. Schritt: Polarisierung des Halogenmoleküls
Nähert sich das Halogenmolekül (hier: Brom) dem Alken (hier: Ethen) oder Alkin, wird es aufgrund der erhöhten negativen Ladungsdichte der Mehrfachbindung polarisiert.
2. Schritt: Anlagerung des ersten Bromatoms
Als nächstes kann das Bromatom, das dem Ethen zugewandt ist, die Doppelbindung des Ethens wegen seiner positiven Ladung aufbrechen. Dabei wird das Brommolekül heterolytisch aufgespalten, es entsteht ein Bromid-Ion. Das Molekül ist nun positiv geladen.
3. Schritt: Anlagerung des zweiten Bromatoms
Als letztes lagert sich das Bromid-Ion an das andere Kohlenstoffatom, das positiv geladen ist. Dadurch werden beide elektrisch neutral.
Halogenalkane
Allgemeines
Ersetzt man in Kohlenwasserstoffverbindungen ein oder mehrere Wasserstoffatom/e durch die Halogenatome Fluor, Chlor, Brom oder Iod, so erhält man die Halogenkohlenwasserstoffe. Diese haben gegenüber den Alkanalen andere Eigenschaften:
- stärkere zwischenmolekulare Kräfte aufgrund von Dipol-Dipol-Wechselwirkungen,
- Lipophilie,
- Verschlechterung der Brennbarkeit, je mehr Wasserstoffatome durch Halogene ersetzt wurden,
- Reaktionsträgheit
Ökologische Bedeutung
Allgemeines
Halogenalkane werden als Pestizide für Pflanzen und Tiere verwendet. Das Insektizid DDT (Dichlor-di-phenyl-trichlorethan) ist sehr beständig und reichert sich wegen seiner Lipophilie in der Nahrungskette an; es darf deshalb in Deutschland seit 1977 weder hergestellt noch verwendet werden. Dennoch findet man heutzutage immer noch selbst bei Säuglingen Belastungen durch DDT.
In der chemischen Reinigung dient Tetrachlorethen als Lösungsmittel für Öle und Fette. Es wird auch „Per“ genannt; dies steht für perchlorierter (durchchlorierter) Kohlenwasserstoff.
Aufgrund ihrer Beständigkeit können Halogenalkane auch für eine lange Zeit in der Atmosphäre, z.B. in der Troposphäre, verweilen und sogar in der Stratosphäre Ozon abbauen.
Ozon (O3)
Ozon ist ein instabiles Molekül, das einen charakteristischen Geruch besitzt und zudem eine toxische Wirkung auf den menschlichen Körper hat. Es reizt die Augen und Schleimhäute, verursacht Husten, Kopfschmerzen und kann die Lunge schädigen. Zudem ist Ozon schlecht wasserlöslich und ist eines der stärksten Oxidationsmittel.
Bildung von Ozon am Boden
Tagsüber wird in Bodennähe durch UV-Strahlung Stickstoffdioxid (NO2) in Stickstoffmonoxid-Radikale und Sauerstoffradikale gespalten. Durch die Reaktion der einzelnen Sauerstoffatome mit Sauerstoffmolekülen entsteht Ozon.
Nachts reagiert das Ozon auch wieder mit dem Stickstoffmonoxid zu Stickstoffdioxid und Sauerstoff.
Sommersmog
Autoabgase (insbesondere NO2) in den Ballungsräumen reagieren unter Einwirkung von Sonnenstrahlung mit Sauerstoff zu Ozon. Aus Ozon und Wasser entstehen Hydroxid-Radikale; Diese, Ozon und andere sogenannten Fotooxidantien oxidieren organische Verbindungen; deshalb müssen ab 240µg/m2 Schutzmaßnahmen ergriffen werden.
Auswirkungen des bodennahen Ozons
Durch das bodennahe Ozon gibt es folgende Auswirkungen:
- Asthmaanfälle und Schädigungen der Atmungsorgane
- Schädigung an Nutzpflanzen (eine Ursache für Waldschäden)
Die Ozonschicht in der Stratosphäre
Es gibt drei Arten der UV-Strahlung: UV-C-Strahlung, UV-B-Strahlung und UV-A-Strahlung. Erstere hat die kürzeste Wellenläge und damit die größte Energie. UV-A-Strahlung hat entsprechend die geringste Energie.
UV-B-Strahlung ist so stark, dass Ozon-Moleküle in Sauerstoffmoleküle und -radikale aufgespalten werden können. Das Sauerstoffradikal wiederum kann mit einem anderen Ozonmolekül zu zwei Sauerstoffmolekülen reagieren.
Die UV-C-Strahlung hingegen ist so stark, dass Sauerstoffmoleküle gespalten werden und dass die dabei entstehenden Radikale mit anderen Molekülen zu Ozon reagieren:
Durch diese Reaktionen entsteht ein Gleichgewicht, sodass die Menge an Ozon in der Stratosphäre eigentlich gleich bleibt. Dies ist wichtig, da die UV-Strahlung ansonsten sogar DNA-Moleküle und allgemein viele Verbindungen, die in der Biologie wichtig sind zerstören könnte.
Problematisch ist aber, dass Ozon sehr reaktiv ist, weswegen es gut mit anderen Teilchen, die in der Atmosphäre vorhanden sind, reagiert. Es gelangen aber wenige Moleküle aus der Troposphäre in die Stratosphäre. Nur Stoffe mit langen Verweilzeiten gelangen in diesen Bereich, z.B. die FCKWs (Fluorchlorkohlenwasserstoffe). Diese – vom Menschen ausgestoßenen Teilchen – tragen zur Zerstörung der Ozonschicht bei:
Die freiwerdenden Chlorradikale der letzten Reaktion werden in der zweiten wieder verwendet. Dadurch entsteht ein Kettenprozess der nachhaltig die Ozonschicht zerstört, wodurch das Ozonloch entsteht.
Polymerisation – vom Monomer zum Polymer
Vorgang der Polymerisation
Wie man bereits bei der elektrophilen Addition gesehen hat, lassen sich die Doppelbindungen bei Alkenen aufbrechen. Das gleiche geschieht bei der so genannten Polymerisation. Hier reagieren die Monomere unter Aufspaltung ihrer Doppelbindungen zu Polymeren.
Nimmt man zum Beispiel den „Baustein“ Ethen, erhält man Polyethen. In diesem ist keine Doppelbindung mehr vorhanden. Geschrieben wird dieser Vorgang folgendermaßen:
n gibt dabei die Anzahl der Monomere an. Die Zahl variiert, das heißt, dass es sowohl kürzere als auch längere Kohlenstoffketten gibt.
Bei der Bildung von Kunststoffen werden aus vielen Monomermolekülen lange Polymerketten, zwischen denen sich zwischenmolekulare Kräfte ausbilden und so feste Körper bilden. Bei geringeren Kräften erhält man weichere Polymere.
Wichtige und häufige Polymere
Für eine Übersicht über wichtige und häufige Polymere, siehe unter Lexikon: Monomere zur Herstellung von Kunststoffen. Dort sind die Namen und Strukturformeln der Monomere sowie die Namen, Abkürzungen und „Repetiereinheiten“ (das, was in den eckigen Klammern steht) der Polymere angegeben.
Alkanole
Alkanole werden im allgemeinen Sprachgebrauch auch Alkohole genannt.
Homologe Reihe der Alkanole
Die Gruppe der Alkanole ist die bekannteste Verbindungsklasse sauerstoffhaltiger organischer Verbindungen. Ein Alkohol bindet mindestens eine Hydroxylgruppe/Hyrdoxygruppe (OH-Gruppe) an einem gesättigten Kohlenstoffatom.
Die Kohlenwasserstoffkette wird Alkylrest genannt, die häufig mit „R-“ abgekürzt wird, z.B. R-OH.
Nomenklatur
An das zugehörige Alkan hängt man ein „-ol“, um den Namen des entsprechenden einfachen Alkanols zu erhalten, z.B. Methanol, Ethanol, Propanol etc. Die anderen Nomenklaturregeln bleiben bestehen, wobei das Kohlenstoffatom mit der OH-Gruppe die möglichst niedrige Zahl erhält.
4-Propyl-5,6-dimethyloctan-2-ol
Stellungsisomerie
Hat ein Alkanol mehr als zwei Kohlenstoffatome ist aus der Summenformel nicht eindeutig feststellbar, an welchem Kohlenstoffatom die Hydroxylgruppe gebunden ist. Am Beispiel von Butanol (C4H9OH) lässt sich das gut erkennen:
| Butan-1-ol | Butan-2-ol | 2-Methylpropan-2-ol | 2-Methylpropan-1-ol |
Wenn Verbindungen die gleiche Summenformel besitzen und sich ausschließlich in der Stellung der funktionellen Gruppe unterscheiden, nennt man dies Stellungsisomerie.
Je nach Stellung der Hydgroxygruppe kann man zwischen drei Gruppen von Alkanolen unterscheiden:
- primäres Alkanol: Das die Hydroxygruppe bindende Kohlenstoffatom ist mit zwei Wasserstoffatomen bzw. einem weiteren Kohlenstoffatom verbunden (z.B. Propan-1-ol)
- sekundäres Alkanol: Das Kohlenstoffatom ist mit einem Wasserstoffatom bzw. zwei anderen Kohlenstoffatomen verbunden (z.B. Propan-2-ol)
- tertiäres Alkanol: Das Kohlenstoffatom ist mit keinem Wasserstoffatom bzw. mit drei Kohlenstoffatomen verbunden (z.B. 2-Methylpropan-2-ol)
Funktionelle Gruppe
Die funktionelle Gruppe eines Moleküls ist der Teil, der die physikalischen und chemischen Eigenschaften und den Namen einer organischen Verbindung wesentlich bestimmt. Beim Alkanol ist dies die OH-Gruppe.
Mehrwertige Alkanole
Alkanole, die eine Hydroxygruppe besitzen, werden einwertige Alkanole und Alkohole mit mehreren Hydroxygruppen mehrwertige Alkanole genannt. So ist Ethandiol ein zweiwertiger Alkohol, Propantriol ein dreiwertiger.
| Ethandiol (auch Glykol genannt) |
Propan-1,2,3-triol (auch Glycerin genannt) |
Vielfältigkeit von Alkanolen
Alkohole können für verschiedene Zwecke genutzt werden.
- Trinkalkohol: Das ist der aus Gärung gewonnene Ethanol
- Frostschutz, Enteisung: Ethan-1,2-diol, Propan-1,2-diol, Propan-2-ol
- Brennstoffe: Bioethanol als Treibstoffzusatz, Spiritus
- Reinigungsmittel: Glasreiniger
- Zusatz in Parfums und Medikamenten
Eigenschaften
Hydroxygruppe und zwischenmolekulare Kräfte
Bei einem Alkanol ist durch die Hydroxygruppe ein Dipol vorhanden. Der Sauerstoff ist dabei δ– und der Wasserstoff δ+. Da dies bei jedem Alkanol der Fall ist, können sich zwischen den Alkoholmolekülen Wasserstoffbrückenbindungen bilden.
Die zwischenmolekularen Kräfte sind allerdings schwächer als bei Wassermolekülen, da das Ethanol nur ein Wasserstoffatom zur Bildung von Wasserstoffbrücken zur Verfügung stellt, während Wasser zwei anbietet. Dadurch liegen die Siedetemperaturen unterhalb der des Wassers, da weniger Energie aufgewendet werden muss, um die zwischenmolekularen Kräfte zu lockern bzw. zu überwinden.
Ethanol kann sich aufgrund seiner unpolaren Ethylgruppe in Alkanen und anderen Ölen und aufgrund seiner polaren Hydroxygruppe in Wasser lösen. Es ist damit also sowohl lipophil als auch hydrophil, während die Lösungsmittel nicht ineinander lösbar sind.
Homologe Reihe und Löslichkeit
Der Alkylrest und die Hydroxygruppe bestimmen das Lösungsverhalten der Alkanole. Bis zum Propanol lösen sie sich unbegrenzt in Wasser; ab Butan-1-ol allerdings nimmt die Wasserlöslichkeit ab, da der Alkylrest zunehmend das Lösungsverhalten bestimmt.
Alkanole haben folgende Eigenschaften:
- steigende Siedetemperaturen innerhalb der homologen Reihe wegen Zunahme der Van-der-Waals-Kräfte
- Siedetemperaturen sind höher als Alkane mit ähnlicher Kettenlänge wegen Ausbildung von Wasserstoffbrücken
- Alkane und entsprechende Alkanole nähern sich mit zunehmender Kettenlänge an
- Bei isomeren Alkanolen liegen verschiedene Siedetemperaturen vor, weil die Oberflächen und somit die Van-der-Waals-Kräfte unterschiedlich stark sind und die Ausbildung von Wasserstoffbrücken verändert ist
- Die Viskosität (Zähflüssigkeit) nimmt zu
Reaktionen von Alkanolen
Oxidation
Die Oxidationszahlen in organischen Verbindungen ermittelt man folgendermaßen:
- Strukturformeln zeichnen
- An das Atom mit der höheren Elektronegativität wird an das Elektronenpaar „-1“ geschrieben, an das andere „+1“; bei gleicher Elektronegativität auf beiden Seiten „0“
- Die Zahlen eines Atoms werden addiert und in römischen Ziffern dazugeschrieben; dies ist die Oxidationszahl
Entscheidend bei einer Redoxreaktion ist die Oxidationszahl des Kohlenstoffatoms mit der funktionellen Gruppe.
Vorgehen zum Lösen von Redoxreaktionen mit Alkanolen
- Aufschreiben der Edukte und Produkte
- Ermitteln der Oxidationszahlen
- Elektronenanzahl aufschreiben
- Ladungsvergleich und -ausgleich (mit Oxonium- oder Hydroxid-Ionen, abhängig von der Lösungsumgebung)
- Richtigstellen der Stoffbilanz (mit Wasser)
Funktionelle Gruppen sauerstoffhaltiger organischer Verbindungen
| Molekül | Name des Moleküls | Funktionelle Gruppe |
| Alkanol | ||
| Alkan-/Carbonsäure | ||
| Alkanal | ||
| Alkanon |
Aldehyde und Ketone
Ein Aldehyd ist ein Alkanal und ein Keton ein Alkanon. Beide sind Oxidationsprodukte von Alkanolen. Sie enthalten als funktionelle Gruppe mindestens die Carbonylgruppe (s. Alkanon). Hergestellt werden Aldehyde durch Oxidation primärer Alkanole und Alkanone durch Oxidation sekundärer Alkohole.
Ketone können nur unter Zerstörung des Moleküls oxidiert werden, d.h. bei der Oxidation eines sekundären Alkanols ist das Alkanon das Endprodukt, während bei der Oxidation eines primären Alkohols ein Alkanal und daraus eine Alkansäure oder direkt eine Carbonsäure entsteht.
Nachweisreaktionen der Aldeyhde
Aldehyde können durch die Fehlingprobe, die Silberspiegelprobe (Tollensprobe) oder die Schiff′sche Probe nachgewiesen werden.
Fehlingprobe
Bei der Fehlingprobe wird die nachzuweisende Substanz in eine tiefblaue Kupfer(II)-Verbindung gegeben. Wenn ein Aldehyd vorliegt, färbt sich die Verbindung rotbraun: Kupfer(I)-oxid entsteht. Der Aldehyd ist zu einer Alkansäure oxidiert.
Silberspiegelprobe/Tollensprobe
Eine unbekannte Substanz wird in eine ammoniakalische Silbernitratlösung, dem Nachweisreagenz, gegeben. Dies wird erwärmt. Falls ein Aldehyd vorliegt, bildet sich an der Wand des Reaktionsgefäßes ein Silberspiegel. Daher der Name Silberspiegelprobe.
Eigenschaften
Eigenschaften der Aldehyde
- homologe Reihe: Methanal, Ethanal, Propanal etc.
- höhere Siedetemperaturen als Alkane, aber niedrigere als Alkohole, da keine Wasserstoffbrücken gebildet werden können
- bis Propanal wasserlöslich, weil der Alkylrest die Eigenschaften des Moleküls nicht wesentlich bestimmt
- ab Butanal kaum hydrophil, da der Alkylrest die Eigenschaften gegenüber dem Aldehydrest stärker bestimmt
Eigenschaften der Ketone
- homologe Reihe: Propanon, Butanon etc.
- höhere Siedetemperaturen als Alkanale, aber niedrigere als Alkohole, da die Polarität einer mittelständigen Carbonylgruppe größer ist und das Molekül kompakter gebaut ist
Benennung von Aldehyden und Ketonen
Bei den Aldehyden wird an das entsprechende Alkan ein „-al“ und bei den Ketonen ein „-on“ angehängt. Die weiteren Regeln bleiben bestehen, wobei die Aldehydgruppe die niedrigste Zahl erhält.
Bei der Bezeichnung eines Moleküls wird es in folgender Reihenfolge benannt: Alkanal, Keton, Alkohol, Alkin, Alken, Alkan. Dabei ist aber auch zu beachten, dass die Endung „-ol“ nicht mit „-al“ oder „-on“ verwendet wird, sondern stattdessen die Vorsilbe „Hydroxy-“ genutzt wird.
Einige Aldehyde und Ketone besitzen auch Trivialnamen. So wird Methanal auch als Formaldehyd und Ethanal als Acetaldehyd bezeichnet. Propanon kann Aceton genannt werden.
Reaktionen der Aldehyden und Ketonen
Einführung
Bei der Carbonylgruppe handelt es sich wie bei der Hydroxygruppe um eine polare Gruppe, da der Sauerstoff wegen seiner höheren Elektronegativität die bindenden Elektronen stärker anzieht. Dadurch wird das Kohlenstoffatom positiv polarisiert. An diesem kann sich ein nukleophiles Teilchen anlagern, weshalb die Reaktion als „nukleophile Addition“ bezeichnet wird. Nukleophile sind Elektronendonatoren, die mindestens ein freies Elektronenpaar besitzen und häufig polarisiert oder negativ geladen sind.
Reaktionsmechanismus der nukleophilen Addition
Der Reaktionsmechanismus der nukleophilen Addition ist eine Donator-Akzeptor-Reaktion, bei der das Nukleophil der Elektronendonator und die Carbonylgruppe der Elektronenakzeptor ist. Die Reaktion verläuft zudem säurekatalysiert.
1. Schritt
Zunächst wird das Sauerstoffatom wird protonisiert; dadurch wird das Kohlenstoffatom positiv geladen. Es bildet sich ein „Carbokation“.
2. Schritt
Als nächstes lagert sich an das positiv geladene Kohlenstoffatom das Nukleophil an. Dies kann zum Beispiel ein Propanolmolekül sein.
3. Schritt
Zum Schluss wird ein Proton abgespalten. Die Reaktion ist deshalb säurekatalysiert.
Produkt der nukleophilen Addition
Das Produkt einer nukleophilen Addition ist, wenn
- sich ein Alkoholmolekül an die Aldehydgruppe eines Alkanals anlagert, ein Halbacetal;
- sich ein Alkoholmolekül an die Ketogruppe eines Ketons addiert, ein Halbketal
Bei einer weiteren Anlagerung eines Alkoholmoleküls an die Hydroxygruppe eines Halbketals/-acetals entsteht ein Vollketal/-acetal.
Besondere Carbonylverbindungen
- Cyclohexanon ist ein Ausgangsstoff für Kunststoffe, wie Perlon, einem Polyamid
- Propenal entsteht beim Braten von Fleischwaren, wenn das Fett zu stark erhitzt wird. Es wird Acrolein
genannt und ist hochgiftig und krebserregend
Strukturformel von Propenal - Aldehyde und Ketone sind häufig Aromastoffe, zum Beispiel ist Vanillin ein Aldehyd, das Zimtaroma kommt vom Zimtaldehyd und der Geruch der Himbeere stammt vom Himbeerketon
Alkansäuren und Ester
Die funktionelle Gruppe einer Alkansäure oder Carbonsäure ist die Carboxygruppe. Die Essigsäure (Ethansäure) ist die wichtigste Alkansäure, da sie eine Grundchemikalie in der chemischen Industrie ist. Essig wird seit Tausenden von Jahren hergestellt, indem Ethanol mithilfe von Essigsäurebakterien, die fast überall auf der Welt vorkommen, in sauerstoffhaltiger Umgebung oxidiert wird.
Alkansäuren reagieren sauer
Carbonsäuren sind Protonendonatoren. In Wasser kommt es zu einer Protolyse. Aus der Säure entsteht ein Carboxylation, ein Anion.
Das Wasserstoffatom der Hydroxygruppe kann sehr leicht abgespalten werden, da das doppelt gebundene Sauerstoffatom die bindenden Elektronen vom Kohlenstoff wegzieht. Dieses zieht als Ausgleich die Elektronen vom Sauerstoff der Hydroxygruppe weg, weshalb der Wasserstoff als Proton abgespalten wird. Dies nennt man Elektronensog.
Die negative Ladung des Carboxylations ist über die gesamte Carboxygruppe verteilt; man bezeichnet dies als delokalisierte Ladung oder delokalisierte Elektronen. Dieses Phänomen ist nicht durch eine Formel darstellbar, weshalb man mehrere Grenzformeln benötigt, zwischen denen die eigentliche Elektronenverteilung liegt. Man nennt dies Mesomerie.
Eine verteilte Ladung ist energetisch günstiger als eine lokalisierte Ladung. Bei einem Alkoholation (z.B. Ethanolat) ist die negative Ladung auf das Sauerstoffatom konzentriert. Dies ist der Grund, weshalb Ethanol gegenüber der Ethansäure keine oder eine sehr schwache Säure ist. Dennoch ist der Protolysegrad bei den Carbonsäuren gering; sie sind auch nur schwache Säuren.
Homologe Reihe
Carbonsäuren bilden eine homologe Reihe. Die Siedetemperaturen liegen höher als die der Alkohole, da die zwischenmolekularen Kräfte aufgrund der höheren Polarität der Carboxygruppe stärker sind. Außerdem sind sie besser wasserlöslich.
Für die Benennung gelten die bekannten Regeln der Nomenklatur, wobei das Kohlenstoffatom der Carboxygruppe die niedrigste Nummer erhält. Außerdem gibt es keine Endung „-ol“. Es wird stattdessen vor den Molekülnamen ein „-Hydroxy-“ gestellt.
Mit diesen Regeln lässt sich das folgende Molekül benennen:
Ester
Als Ester werden Moleküle bezeichnet, die aus der Reaktion eines Alkohols mit einer Carbonsäure entstehen. Sie haben als funktionelle Gruppe -COOR (siehe rechts). Bei der Synthese wird Wasser abgespalten. Man spricht daher auch von einer Esterkondensation. Falls eine Säure und ein Alkohol aus Wasser und dem Ester entstehen, liegt eine säurekatalysierte Esterhydrolyse vor.
Verschiebung
Die Esterbildung und Esterspaltung laufen gleichzeitig ab. Man nennt dies Gleichgewichtsreaktion. Das Gleichgewicht ist abhängig von Außenfaktoren wie Druck, Temperatur und Anwendung von Katalysatoren. Diese können das Gleichgewicht auf die linke oder rechte Seite des Reaktionsmechanismus verschieben.
Man kann die Reaktion auch verschieben, indem man einen Reaktionspartner wegnimmt. Nimmt man zum Beispiel Ester, so wird neuer Ester gebildet, um das Gleichgewicht zu erhalten. Somit sinkt auch die Konzentration der Edukte. Man kann ebenfalls deren Konzentration erhöhen, um mehr Ester zu erhalten.
Benennung
Man erhält den Namen des Esters, indem man den Namen der Säure nimmt und die Bezeichnung der Gruppe des Alkohols anhängt.
Nimmt man beispielsweise den Ester, der aus der Synthese von Propansäure und Propanol gebildet wird, erhält man als Produkt Wasser und Propansäurepropylester.
Proteine
Aminosäuren: Bausteine der Proteine
Proteine bestehen aus Aminosäuren (kurz für Aminocarbonsäuren), von denen es 20 verschiedene gibt. Sie haben einen gleichen Aufbau und unterscheiden sich nur in einem Rest R, der ein Wasserstoffatom oder eine Molekülgruppe ist:
Unpolare Aminosäuren haben als Rest eine unpolare Gruppe. Beispiele sind zum Beispiel Alanin mit einer Methylgruppe und Glycin mit einem Wasserstoffatom als Rest. Polare Aminosäuren haben eine polare Gruppe, saure eine Carboxygruppe und basische eine Aminogruppe im Rest.
Aminosäuren: Zwitterionen
Da es sich bei der Carboxygruppe um eine saure und bei der Aminogruppe um eine basische Molekülgruppe handelt, kann ein Proton abgespalten bzw. aufgenommen werden. Dieses geschieht innerhalb des Moleküls (Protonenwanderung). Durch die Ionen bilden die Aminosäuren Salze. Die Aminosäure, bei der das Proton gewandert ist, nennt man Zwitterion.
Aminosäuren: Puffereigenschaften
Die Aminosäuren und Proteine haben Puffereigenschaften, was bedeutet, dass sie in der Lage sind, sowohl Oxoniumionen als auch Hydroxidionen aufzunehmen. Dadurch wird der pH-Wert konstant gehalten.
Quellen
- Alkane
- ↑https://commons.wikimedia.org, Aglarech